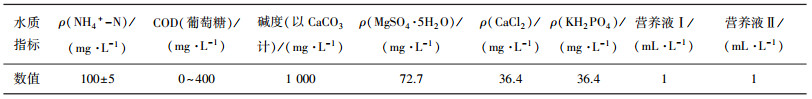2. 郑州轻工业学院 环境污染治理与生态修复河南省协同创新中心, 450001 郑州;
3. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 150090 哈尔滨
2. Collaborative Innovation Center of Environmental Pollution Control and Ecological Restoration, Zhengzhou University of Light Industry, 450001 Zhengzhou, China;
3. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), 150090 Harbin, China
目前, 水体中氮素污染物的去除仍是水处理领域研究的热点与难点.传统硝化-反硝化脱氮工艺虽然脱氮效率高, 但投资与运行费用高, 耗能大, 污泥产量高[1].基于亚硝化的全程自养脱氮(CANON)[2]工艺有效地克服了传统脱氮工艺中固有的缺点.CANON工艺是指氨氧化菌(AOB)和厌氧氨氧化(Anammox)菌共存于同一反应器内, AOB在微氧条件下, 以氧作为电子受体将NH4+-N部分氧化为NO2--N, Anammox菌以AOB产生的NO2--N为电子受体, 与剩余NH4+-N反应, 生成N2并释放, 达到脱氮目的.CANON系统内化学计量方程式如下
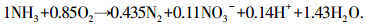
|
(1) |
CANON工艺因具有高效脱氮、耗能少、无需外加碳源且污泥产量低等优点受到国内外诸多学者的青睐.但根据式(1), 理论上CANON工艺只能达到89%的总氮去除率, 产生11%左右的NO3--N无法根除.并且, 只含氨氮不含有机物的水体几乎不存在, 由于AOB和Anammox菌均是自养菌, 有机物的存在势必对这两种菌产生影响.如何同时去除水体中的氨氮和有机物, 进一步提高脱氮效率, 是研究学者努力的方向.Chen等[3]提出了同步亚硝化、厌氧氨氧化和反硝化(SNAD)工艺, 即在同一反应器内AOB和Anammox菌共同完成CANON反应, 反硝化细菌以有机物为电子供体, 将产生的少量NO3--N还原为N2, 解决了上述难题.近年来, SNAD工艺的研究多集中在化肥工业废水、养猪废水等高氨氮、低碳氮比的废水处理中[4-6], 而关于不同有机物质量浓度对SNAD工艺的影响及将其应用于低氨氮、高碳氮比的生活污水的处理少见报道.本研究以MBR系统内SNAD工艺为对象, 探讨了不同有机物质量浓度对SNAD工艺的影响及对系统内AOB和Anammox菌种群结构的影响, 进一步考察SNAD工艺应用于实际生活污水同步脱氮除有机物的处理, 以期为该工艺应用于工程实践提供理论依据.
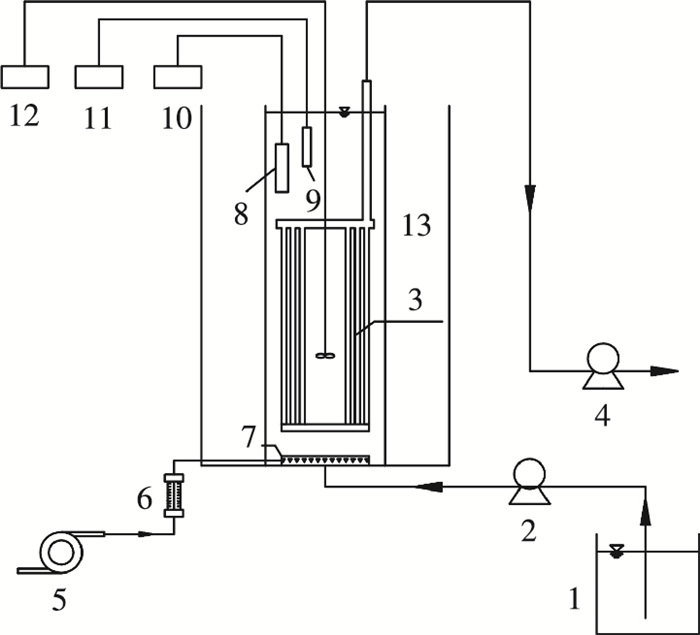
1 实验 1.1 实验装置本实验在已成功以连续流方式运行CANON工艺的基础上进行.运行期间, 曝气量为0.2 mL/min、NH4+-N质量浓度为150 mg/L时, NH4+-N去除率、总氮去除率和氮去除负荷分别为88%、51.67%和0.45 kg/(m3·d).实验装置为有机玻璃制成的圆柱形MBR反应器, 如图 1所示.圆柱内径13 cm, 高度40 cm, 有效容积3 L, 内置聚偏氟乙烯(PVDF)中空纤维膜组件, 膜孔径为0.1 μm, 有效膜面积为0.2 m2, 膜通量36 L/h.反应器底部设置曝气环, 采用鼓风曝气, 曝气量由转子流量计控制, 中间设有搅拌机, 用于基质和O2均匀扩散, 外部设置水浴套筒, 由温度控制仪控制反应器内温度.
|
1—进水箱; 2—进水泵; 3—膜组件; 4—出水泵; 5—鼓风机; 6—气体流量计; 7—曝气环; 8—DO电极; 9—pH电极; 10—DO在线测定仪; 11— pH在线测定仪; 12—搅拌机; 13—水浴. 图 1 实验装置示意 |
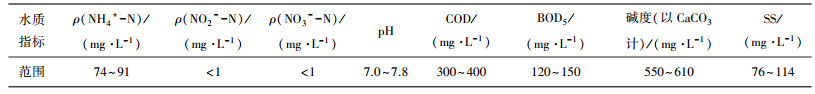
实验用水前期采用人工配水, 分别以(NH4)2SO4、NaHCO3和葡萄糖作为NH4+-N、碱度和COD的来源.进水中额外添加MgSO4·5H2O、CaCl2、KH2PO4和营养液Ⅰ、Ⅱ作为营养物质, 营养液Ⅰ包括EDTA 5 000 mg/L和FeSO45 000 mg/L.营养液Ⅱ包括EDTA 15 000 mg/L、ZnSO4·7H2O 430 mg/L、CoCl2·6H2O 240 mg/L、MnCl2·4H2O 990 mg/L、CuSO4·5H2O 250 mg/L、Na2MoO4·2H2O 220 mg/L、NiCl2·6H2O 190 mg/L、Na2SeO4·10H2O 210 mg/L和H3BO414 mg/L, 水质情况见表 1.后期实验用水取自北京工业大学教工家属西区化粪池中的生活污水, 不再另外投加任何其他物质, 水质情况见表 2.
| 表 1 人工配水水质 |
| 表 2 生活污水水质 |
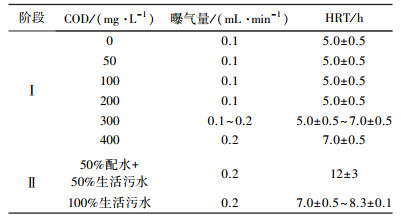
实验在常温(23~25)℃条件下采用连续流方式运行, 分为两个阶段:第Ⅰ阶段, 配水运行, COD为0、50、100、200、300、400 mg/L; 第Ⅱ阶段, 生活污水运行.不同阶段主要运行条件见表 3.
| 表 3 不同阶段主要运行条件 |
NH4+-N、NO2--N、NO3--N、COD等指标均采用国家规定的标准方法测定[7]; DO、ORP、pH及温度测定分别采用EUTECH DO2000PPG多功能溶解氧在线测定仪、WTW ORP296型在线测定仪、WTW pH296型在线测定仪测定.
1.4 DNA提取、PCR-DGGE、克隆和测序 1.4.1 基因组DNA的提取在COD为0、200、400 mg/L及生活污水运行稳定期, 从MBR反应器内采集混合液.用UNIQ-10柱式细菌基因组DNA抽提试剂盒(上海生工)提取基因组DNA, 具体操作按说明书进行.所提取的基因组DNA用0.8%(质量分数)的琼脂糖凝胶电泳检测, 以备PCR用.
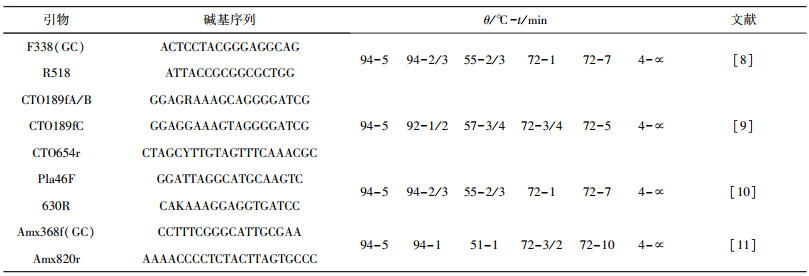
1.4.2 PCR扩增及DGGE电泳采用巢式PCR方法, 分别扩增β-proteobacteria菌门的AOB, Planctomycetales菌门的Anammox菌.为扩增AOB的16S rDNA, 第一轮扩增使用CTO189fA/B和CTO189fC混合引物(体积比2:1)作为正向引物, 反向引物采用CTO654r.之后以第一轮PCR扩增产物为模板, 使用通用引物对F338(带GC夹)/R518进行第二轮PCR扩增.对于Anammox菌特异性片段的扩增, 第一轮先以引物对Pla46F/630R进行浮霉球菌扩增.之后以第一轮PCR扩增产物为模板, 使用引物对Amx368f(带GC夹)/Amx820r进行第二轮PCR扩增.PCR反应体系为25 μL, 其中包含2.5 μL 10 × Ex Taq buffer (Mg2+ Plus), 2.0 μL DNTP, 1.0 μL BSA, 1.0 μL引物, 0.125 μL TaKaRa Ex Taq酶, 模板DNA约1.0 ng, 用无菌水补齐至25 μL.引物碱基序列及反应条件见表 4.
| 表 4 PCR常用引物对应程序 |
PCR扩增产物用1.5%(质量分数)的琼脂糖凝胶进行电泳检测.采用Sanprep柱式DNA胶回收试剂盒(上海生工)进行PCR产物的纯化回收, 具体操作按说明书进行.对PCR产物进行DGGE分析:聚丙烯酰胺质量分数8%, 变性梯度为30%~60%, 电压120 V, 电泳时间5 h, 电泳在Dcode Universal Mutation Detection System仪器上进行.电泳结束后按Bassam等[12]的方法对凝胶进行银染和拍照.
1.4.3 克隆和测序切取DGGE图谱中的目的条带溶于150 μL TE(pH 8.0)溶液中, 4 ℃过夜, 以此为模板, 以不含GC夹的引物进行PCR扩增, 并对PCR产物进行纯化.按照pMD19-T plasmid vector system说明书进行基因片段与载体的连接后, 转化到大肠杆菌DH5α感受态细胞中, 通过蓝白斑法筛选阳性克隆子, 过夜培养后进行测序.采用BLAST对测序结果和基因库中已知序列进行相似性分析.
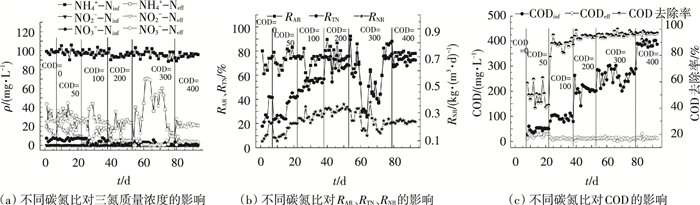
2 结果与讨论 2.1 反应器运行性能 2.1.1 配水阶段反应器运行性能此阶段主要探讨不同碳氮比对SNAD工艺运行性能的影响及调控方法.NH4+-N质量浓度为100 mg/L, COD依次从0 mg/L逐渐递增到400 mg/L, 本阶段反应器运行效果如图 2所示.由图 2(a)可以看出, 0~53 d, 随着碳氮比的增大, 即分别为0、0.5、1.0、2.0, 出水NH4+-N质量浓度基本不变, 维持在24 mg/L, 出水NO2--N和NO3--N质量浓度逐渐减小, 分别下降到0.2和5.0 mg/L左右.图 2(b)也显示NH4+-N去除率(RAR)一直在75%左右, 总氮去除率(RTN)和氮去除负荷(RNR)由于出水NO2--N和NO3--N质量浓度的减小, 不断增大至67%和0.34 kg/(m3·d)左右.当碳氮比为3时, 由于HRT控制不稳, 导致第54~59天出水NH4+-N质量浓度变化也较大, 但第60~64天HRT稳定后, 出水NH4+-N质量浓度明显增高, RTN和RNR降低, 因此, 第65~71天, 曝气量由0.1 mL/min调至0.2 mL/min, 以氧化更多的NH4+-N, 此时, 出水NH4+-N质量浓度只是轻微减小.在第72~79天将HRT由(5.0±0.5)增大至(7.0±0.5)h, 出水NH4+-N质量浓度进一步降至13.0 mg/L左右, 出水NO3--N质量浓度增加到9.3 mg/L, RTN上升到75%左右, RNR有所回升, 为0.23 kg/(m3·d)左右.继续增大碳氮比至4, 出水NH4+-N质量浓度增加至21.0 mg/L, 而出水NO3--N质量浓度减小至4.0 mg/L, RTN和RNR分别为72%和0.24 kg/(m3·d).图 2(c)表明, 当COD为50 mg/L时, 出水COD在23~30 mg/L, 随着COD的增加, 出水COD变化范围为9.0~14.0 mg/L, COD去除率不断增大, 在95%以上.
|
图 2 配水阶段反应器运行性能 |
此阶段引入生活污水, 如图 3所示.第94~103天, 进水为人工配水和生活污水各一半, 混合均匀,考虑到生活污水中好氧异养微生物较多, 会消耗较多的溶解氧, 将HRT增大到12 h左右.从图 3可以看出, 出水NH4+-N质量浓度在3 mg/L左右, 出水NO2--N接近0 mg/L, 出水NO3--N质量浓度为3 mg/L左右, 出水COD在25~33 mg/L波动. RAR和RTN分别达95%和89%以上.第104~120天为完全原水运行时期, 由于进水中只加入50%生活污水时, RAR和RTN已较高, 便将HRT减小到(7.0±0.5) h.前9 d, 随着反应器的运行, 出水NH4+-N质量浓度越来越大, 导致RTN和RNR急剧下降.第114天将HRT增加至(8.3±0.1) h, 出水NH4+-N质量浓度迅速降至23.0 mg/L左右, 出水NO2--N和NO3--N质量浓度几乎为0 mg/L, RTN和RNR也分别上升到73%和0.17 kg/(m3·d)左右, 出水COD略升至30.0~40.0 mg/L, COD去除率达90%左右.
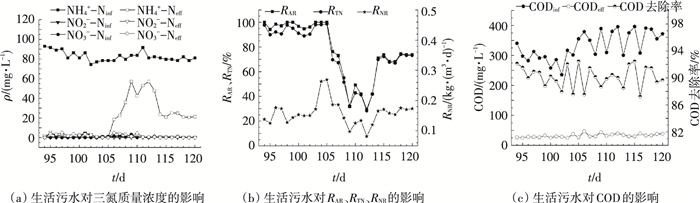
|
图 3 生活污水阶段反应器运行性能 |
由于AOB和Anammox菌是自养菌, 不需要有机物作为碳源或能源物质, 当反应器中存在有机物时, 势必会改变其生存环境的物化特性, 从而促进或抑制其生长和脱氮性能.本实验配水运行阶段, 当碳氮比≤2时, 随着COD的增加, RAR基本保持不变, RTN和RNR由于出水NO2--N和NO3--N质量浓度的减少而增大.这是因为在低质量浓度有机碳源下, AOB和Anammox菌未受到影响, 而反硝化细菌活性增强, 通过反硝化作用将NO2--N和NO3--N还原为N2, 提高了脱氮效率.有学者[13-15]认为低质量浓度的有机物不会显著影响Anammox反应, 反而通过反硝化作用提高总氮去除率.当碳氮比为3时, 出水NO3--N质量浓度进一步下降, 但出水NH4+-N质量浓度上升幅度较大.有机碳源对AOB和Anammox菌的抑制作用表现为:有机物的加入会使好氧异养菌繁殖, 与AOB竞争O2, 从而抑制AOB的活性; 同时, 会使反硝化细菌生长, 与Anammox菌竞争底物NO2--N, 致使Anammox菌活性降低甚至失活[4].周少奇[16]发现高碳源环境下, 由于反硝化菌的生长速率大于Anammox菌, 大量繁殖, 在竞争NO2--N时占优势.本研究中导致出水NH4+-N质量浓度升高, 理论上可能存在以下原因:①因好氧异养菌大量繁殖, AOB受到抑制, 导致Anammox菌所需的底物——NO2--N减少, 也受到抑制; ②AOB未受到影响, 因反硝化菌的过度繁殖, 使得NO2--N减少Anammox菌受到抑制; ③因好氧异养菌和反硝化菌均大量繁殖, 致使AOB和Anammox菌同时受到抑制.分析如下:如图 4(a)所示, 当碳氮比为0、0.5、1.0、2.0, 曝气量为0.1 mL/min时, DO维持在0.3 mg/L, 而ORP由-22 mV逐渐减小到-105 mV左右.反应器内随着碳氮比的增加, DO相对稳定, O2可供好氧异养菌和AOB同时利用, 表明在碳氮比≤2的条件下, 在竞争O2时, 好氧异养菌未对AOB菌造成不利影响, 而ORP的减小是因为反硝化菌的作用.文献[17]在研究循环式活性污泥法时认为, 在缺氧区ORP能指示反硝化碳源是否充足, 即反硝化作用加强会导致ORP减小.虽然存在反硝化菌, 但在低质量浓度有机碳源下, 其对NO2--N的亲和力要小于Anammox菌对NO2--N的亲和力[18],所以Anammox菌也未受到抑制, 这与反应器内氮素变化情况一致.当碳氮比为3时, 第54~64天, DO和ORP大幅下降(文献[17]的研究表明,ORP随着DO质量浓度的下降而下降), 高质量浓度有机物的存在使好氧异养菌大量繁殖, 消耗大量O2, AOB可能由于供氧不足受到抑制, 生成少量的NO2--N, Anammox菌因基质NO2--N质量浓度不足活性降低, 导致出水NH4+-N质量浓度升高, RNR降低.根据以上分析将O2调至0.2 mL/min, 此时DO仍为0.1 mg/L, 出水NH4+-N质量浓度降低, 但还是较高, 第72天, 增大HRT, DO为0.2 mg/L, 出水NH4+-N质量浓度进一步降低.当碳氮比为4时, DO减至0.1 mg/L, 出水NH4+-N质量浓度轻微升高.如图 4(b)所示, 生活污水运行阶段同理, 不再赘述.
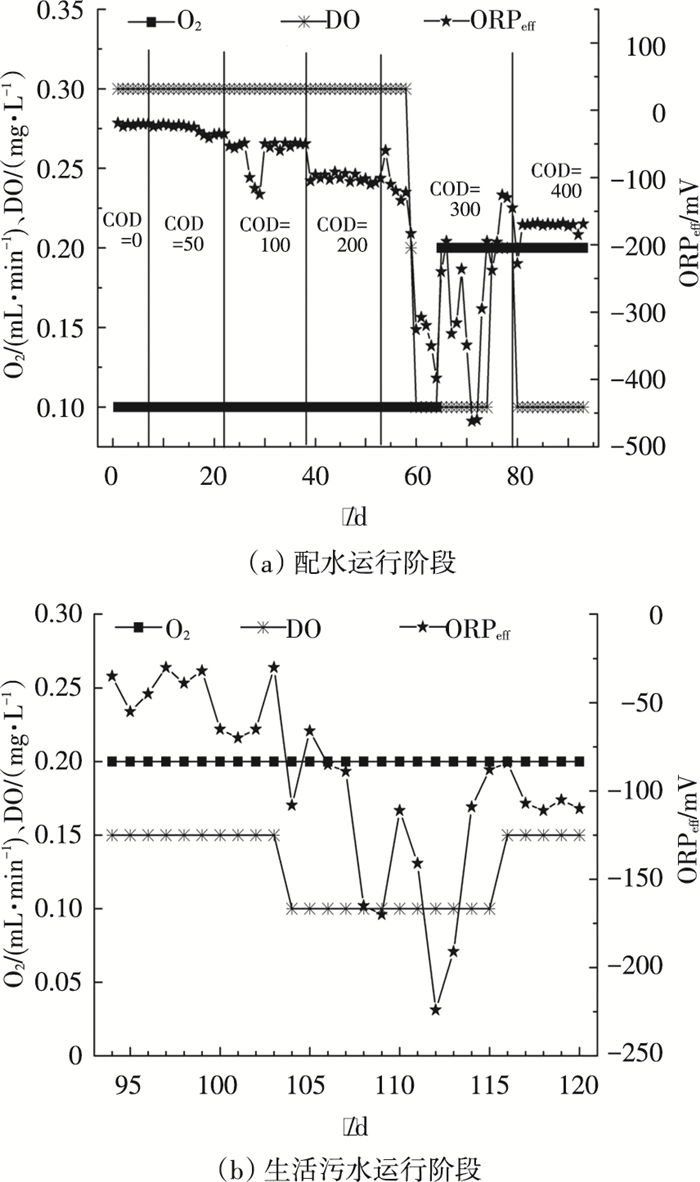
|
图 4 不同阶段O2、DO、ORP的变化 |
由以上分析可知, 当碳氮比为3时, 出水NH4+-N质量浓度升高的原因符合第①种.若是因为AOB未受到影响, 反硝化菌过度繁殖, 便会导致反应器内ORP的升高, 与此时DO和ORP大幅下降的现象不符.若是因为好氧异养菌和反硝化菌均大量繁殖, 当增大DO质量浓度或HRT, 虽然AOB活性恢复, 但由于反硝化菌继续大量增殖与Anammox菌竞争NO2--N, 势必会抑制Anammox菌, 加之后期碳氮比为4, Anammox菌一直处于劣势, 种群结构会受到影响, 但2.3节DGGE图谱显示Anammox菌种群结构在运行期间未发生变化.所以, 本研究中碳氮比≥3致使反应器脱氮性能下降, 主要是好氧异养菌大量繁殖, AOB受到抑制所致.
从图 2(c)可以看出,COD去除率随COD的增加而增大.原因是当COD较低时, 异养菌数量较少, 只能氧化少量的有机物, 当COD越来越大, 异养菌大量增殖, 氧化了大量有机物.比较配水运行阶段与生活污水运行阶段出水COD, 后者偏大, 主要是由原水中存在难降解有机物所致.
图 5为实验结束时, 曝气量为0.2 mL/min, 以生活污水为进水的周期实验.0~10 h, COD逐步下降, 而NH4+-N质量浓度变化不明显, 说明COD最先被好氧异养菌氧化, 并消耗O2, 抑制了AOB的活性.当COD降至89.42 mg/L时, NH4+-N质量浓度开始下降, AOB和Anammox菌发挥作用, 同时反硝化细菌将生成的NO3--N还原为N2, 使得NO3--N质量浓度没有升高, AOB、Anammox菌和反硝化细菌共同完成脱氮作用.同时也说明在高碳氮比的情况下, 由于好氧异养菌先将大部分COD去除, 解除了反硝化细菌过度繁殖竞争基质NO2--N对Anammox菌的不利影响, 这也是本实验中虽然碳氮比高于其他学者研究值[15, 19], 但在短期内未对Anammox菌产生抑制的原因.
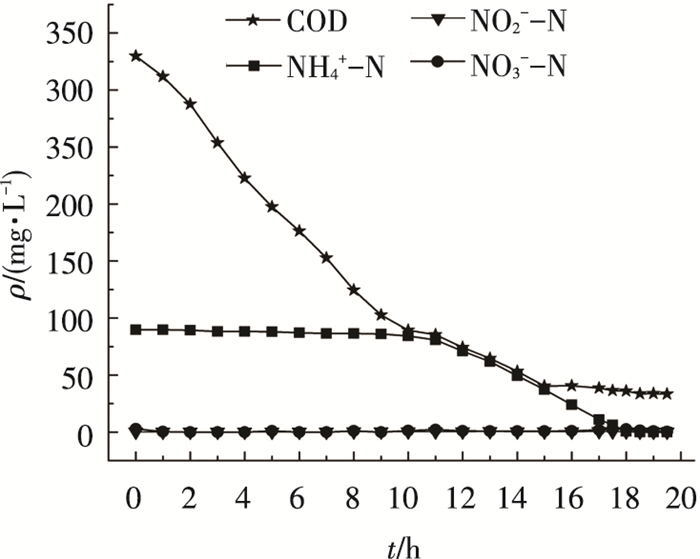
|
图 5 周期实验中COD、三氮质量浓度的变化 |
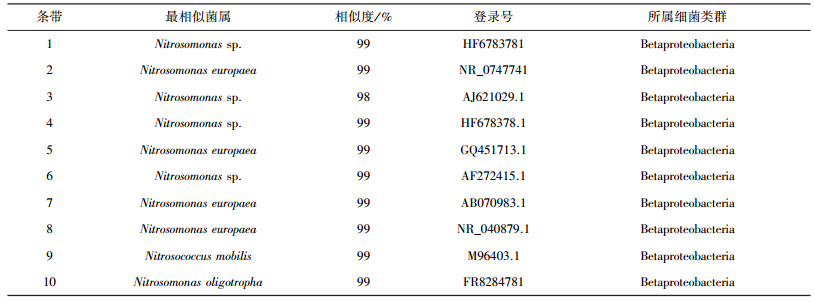
图 6中a、b、c、d 4个泳道分别对应COD为0、200、400 mg/L及生活污水运行阶段AOB的DGGE图谱.对图中10个条带进行DNA基因序列测序, 结果表明,所有AOB均属于β-proteobacteria, 主要是Nitrosomonas, 包括Nitrosomonas sp.、Nitrosomonas europaea、Nitrosococcus mobilis和Nitrosomonas oligotropha且相似度均在98%及以上, 如表 5所示, 表明Nitrosomonas是反应器内的优势菌种.Ducey等[20]在研究亚硝化时, 对153个克隆的16S rRNA基因序列进行测序分析, 结果表明大部分属于Nitrosomonas. Liu等[21]认为相对于Nitrosospira, Nitrosomonas更适于在CANON反应器中生长.对比4个阶段AOB的种群结构变化可以看出:碳氮比由0~2, 条带数量均为10, 无条带缺失, AOB菌属种类不受影响; 当碳氮比为4时, 条带数量减少到9, 缺少了条带4(Nitrosomonas sp.), AOB种群结构有所变化, 菌属种类减少, 说明在高质量浓度有机碳下, 好氧异养菌快速增殖竞争O2, AOB受到抑制; 在处理生活污水时, 条带数量减少至8, 缺少了条带4(Nitrosomonas sp.)和条带6(Nitrosomonas sp.), AOB菌属种类进一步减少, 原因是生活污水中存在多而繁杂的好氧异养菌, 其引入对AOB更为不利, 影响了AOB的种群结构.
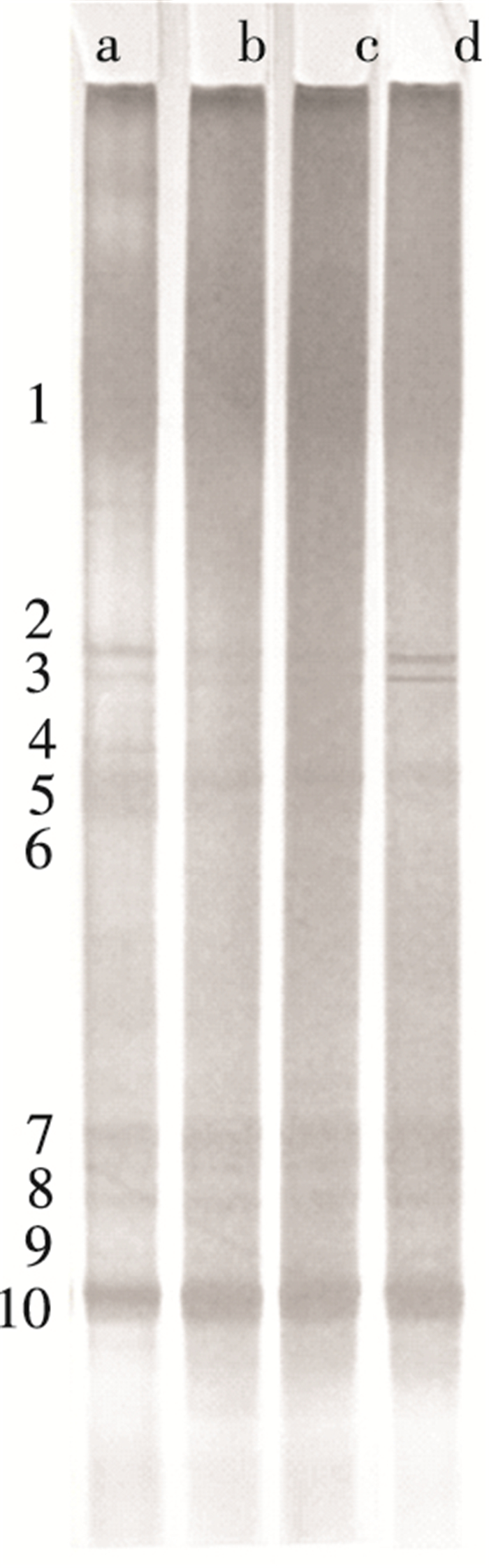
|
图 6 AOB的DGGE图谱 |
| 表 5 DGGE条带上AOB的DNA序列比对结果 |
图 7中a、b、c、d 4个泳道分别对应COD为0、200、400 mg/L及生活污水运行阶段Anammox菌的DGGE图谱.对图中3个条带进行DNA基因序列测序, 结果表明均属于Planctomycetia, 包括Candidatus Kuenenia stuttgartiensis和anaerobic ammonium-oxidizing planctomycete, 相似度高达99%及以上(表 6).Hu等[22]的研究表明,Candidatus Kuenenia stuttgartiensis是一种存在于淡水环境中的Anammox, 且在污水脱氮系统中常见[23].
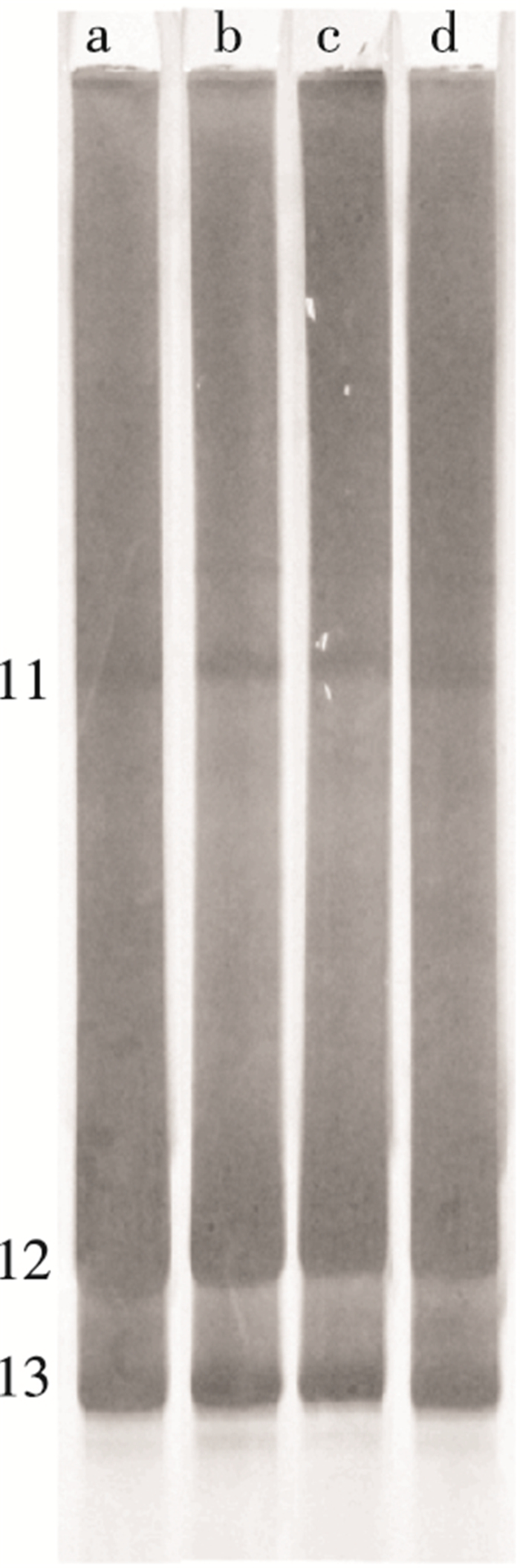
|
图 7 Anammox菌的DGGE图谱 |
| 表 6 DGGE条带上Anammox菌的DNA序列比对结果 |
从图 7可以看出, 在4个阶段中Anammox菌菌属种类没有变化, 全部为3个同位置的条带, 说明在碳氮比由0增到4的过程中, 通过及时调整运行参数, 短期内Anammox菌种群结构不会受到影响.AOB和Anammox菌的DGGE图谱分析表明,Nitrosomonas和Candidatus Kuenenia stuttgartiensis一直是反应器内的优势菌种, 共同完成脱氮过程, 且有机物对种群结构的影响与对反应器脱氮性能的影响一致.
3 结论1) 碳氮比为0~2(ρ(NH4+-N)=100 mg/L、COD为0~200 mg/L)条件下, COD的增加不会抑制AOB和Anammox菌, 反而通过反硝化作用提高氮去除负荷.总氮去除率和氮去除负荷平均分别为67%和0.34 kg/(m3·d).可见, SNAD工艺对于低碳氮比废水的脱氮处理有很好的应用前景.
2) 碳氮比为3~4(ρ(NH4+-N)=100 mg/L、COD为300~400 mg/L)及生活污水运行条件下, 由于大量COD的存在使得好氧异养菌不断增殖, 抑制AOB的活性, 脱氮效率下降, 影响自养系统脱氮性能的稳定性, 可通过调整曝气量和HRT改善出水水质.生活污水运行阶段, 总氮去除率和氮去除负荷平均分别为73%和0.17 kg/(m3·d), 反应器脱氮性能尚需进一步提高.
3) 人工配水阶段,随碳氮比的增加, COD去除率不断升高, 在95%以上.生活污水运行阶段, 由于存在难降解有机物,COD去除率在90%左右.可见, SNAD工艺可以提高脱氮效率, 还可有效去除有机物.
4) AOB和Anammox菌的DGGE图谱分析表明:碳氮比为0~2时, COD的增加对AOB和Anammox菌的菌属种类无影响.碳氮比为3~4及生活污水运行时, COD的增加使AOB菌属种类减少,而通过及时调控运行参数(DO、HRT)短期内Anammox菌不会受到影响, 对其长期作用还需进一步研究.这与反应器的脱氮性能变化一致.Nitrosomonas和Candidatus Kuenenia stuttgartiensis一直是反应器内的优势菌种, 共同完成脱氮过程.以后, 可着重研究如何创造有利于这两种菌生存的环境.
| [1] |
BAGCHI S, BISWAS R, NANDY T. Autotrophic Ammonia removal processes:ecology to technology[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(13): 1353-1418. DOI:10.1080/10643389.2011.556885 |
| [2] |
SLIEKERS A O, DERWORT N, GOMEZ J L, et al. Completely autotrophic nitrogen removal over nitrite in one single reactor[J]. Water Research, 2002, 36(10): 2475-2482. DOI:10.1016/S0043-1354(01)00476-6 |
| [3] |
CHEN Huihui, LIU Sitong, YANG Fenglin, et al. The development of simultaneous partial nitrification, ANAMMOX and denitrification (SNAD) process in a single reactor for nitrogen removal[J]. Bioresource Technology, 2009, 100(4): 1548-1554. DOI:10.1016/j.biortech.2008.09.003 |
| [4] |
贾丽, 郭劲松, 方芳, 等. 有机碳源对单级自养脱氮系统脱氮性能及微生物群落结构的影响[J]. 重庆大学学报, 2013, 36(3): 96-103. DOI:10.11835/j.issn.1000-582X.2013.03.017 |
| [5] |
KELUSKAR R, NERURKAR A, DESAI A. Development of a simultaneous partial nitrification, anaerobic ammonia oxidation and denitrification (SNAD) bench scale process for removal of ammonia from effluent of a fertilizer industry[J]. Bioresource Technology, 2013, 130: 390-397. DOI:10.1016/j.biortech.2012.12.066 |
| [6] |
DAVEREY A, HUNG N, DUTTA K, et al. Ambient temperature SNAD process treating anaerobic digester liquor of swine wastewater[J]. Bioresource Technology, 2013, 141: 191-198. DOI:10.1016/j.biortech.2013.02.045 |
| [7] |
魏复盛, 国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002.
|
| [8] |
KOWALCHUK G A, STEPHEN J R, DEBOER W, et al. Analysis of ammonia-oxidizing bacteria of the beta subdivision of the class Proteobacteria in coastal sand dunes by denaturing gradient gel electrophoresis and sequencing of PCR-amplified 16S ribosomal DNA fragments[J]. Appliedand Environmental Microbiology, 1997, 63(4): 1489-1497. |
| [9] |
MUYZER G, DEWALL E C, UITTERLINDEN A G, et al. Profilin of complex microbial-populations by denaturing gradient gel-electrophoresis analysis of polymerase chain reaction-amplified genes-coding for 16s ribosomal-RNA[J]. Appliedand Environmental Microbiology, 1993, 59(3): 695-700. |
| [10] |
NEEF A, AMANN R, SCHLESNER H, et al. Monitoring a widespread bacterial group:in situ detection of planctomycetes with 16S rRNA-targetedprobes[J]. Microbiology-UK, 1998, 144(2): 3257-3266. |
| [11] |
SCHMID M, WALSH K, WEBB R, et al. Candidatus "Scalindua brodae", sp. nov., Candidatus "Scalindua wagneri", sp. nov., two new species of anaerobic ammonium oxidizing bacteria[J]. Systematic and Applied Microbiology, 2003, 26(4): 529-538. DOI:10.1078/072320203770865837 |
| [12] |
BASSAM B J, CAETANO-ANOLLES G, GRESSHOFF P M, et al. Fast and sensitive silver staining of DNA in polyacrylamide gels[J]. Analytical Biochemistry, 1991, 196(1): 80-83. DOI:10.1016/0003-2697(91)90120-I |
| [13] |
杨洋, 左剑恶, 沈平, 等. 温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J]. 环境科学, 2006, 27(4): 691-695. |
| [14] |
吕永涛, 陈祯, 吴红亚, 等. 有机物质量浓度对厌氧氨氧化脱氮性能影响实验研究[J]. 环境工程学报, 2009, 3(7): 1189-1192. |
| [15] |
NI Shouqing, NI Jianyuan, HU Deliang, et al. Effect of organic matter on the performance of granular anammox process[J]. Bioresource Technology, 2012, 110: 701-705. DOI:10.1016/j.biortech.2012.01.066 |
| [16] |
周少奇. 厌氧氨氧化与反硝化协同作用化学计量学分析[J]. 华南理工大学学报(自然科学版), 2006, 34(5): 1-4. |
| [17] |
申福维, 阳春, 张智, 等. 循环式活性污泥法氧化还原电位的生产性研究[J]. 水处理技术, 2011, 37(1): 55-57. |
| [18] |
AHN Y. Sustainable nitrogen elimination biotechnologies:a review[J]. Process Biochemistry, 2006, 41(8): 1709-1721. DOI:10.1016/j.procbio.2006.03.033 |
| [19] |
叶建锋, 薄国柱. 低碳源条件下厌氧氨氧化影响因素的研究[J]. 水处理技术, 2006, 32(9): 30-33. |
| [20] |
DUCEY T F, VANOTTI M B, SHRINER A D, et al. Characterization of a microbial community capable of nitrification at cold temperature[J]. Bioresource Technology, 2010, 101(2): 491-500. DOI:10.1016/j.biortech.2009.07.091 |
| [21] |
LIU Sitong, YANG Fenglin, XUE Yuan, et al. Evaluation of oxygen adaptation and identification of functional bacteria composition for anammox consortium in non-woven biological rotating contactor[J]. Bioresource Technology, 2008, 99(17): 8273-8279. DOI:10.1016/j.biortech.2008.03.006 |
| [22] |
HU Baolan, ZHENG Ping, CHEN Jianwei, et al. Identification and quantification of anammox bacteria in eight nitrogen removal reactors[J]. Water Research, 2010, 44(17): 5014-5020. DOI:10.1016/j.watres.2010.07.021 |
| [23] |
SCHMID M, TWACHTMANN U, KLEIN M, et al. Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation[J]. Systematic and Applied Microbiology, 2000, 23(1): 93-106. DOI:10.1016/S0723-2020(00)80050-8 |
 2016, Vol. 48
2016, Vol. 48