煤的热解过程是煤燃烧气化的一个重要的初始阶段,对煤的着火点和燃烧的稳定性及后期的燃尽问题有很大影响.因此,深入研究煤的热解过程对资源的有效利用有着重要的意义[1].
目前研究煤热解动力学的方法有很多,较常见的有模型拟合法[2]、等转化率法[3]、DAEM模型法[4-5].模型拟合法指将常用的动力学机理函数带入非等温动力学方程进行逐一拟合,最终多次尝试取拟合效果最好者[6].然而,为得到较好的拟合效果,常常会将相应的修正因子引入到动力学函数中,或将反应级数取成表观反应级数形式[7],这可使数学拟合效果提高,但放弃了反应模型的物理意义[8].而等转化率法(或DAEM法),只能计算出不同转化率下的活化能,得不到相应的动力学机理函数及相关参数,不能准确描述整个热解动力学过程[9].分段法更强调煤热解动力学过程的物理意义,以得到相应的控速环节、热解机理和动力学参数为目的,而非单纯的数学拟合过程.这有利于更深入的认识煤的热解动力学过程.此外,在模型建立的过程中由于相应的边界条件及结构参数的引入,使得所求出的相关动力学参数应用范围更广,为进一步的数值模拟及扩大生产过程奠定了必要的基础.
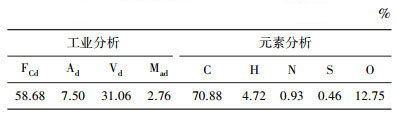
1 实验实验所用兴隆庄煤属烟煤,其工业分析和元素分析见表 1.
| 表 1 兴隆庄煤的工业分析和元素分析 |
实验采用Netzsch NO. STA 449 F3的综合热分析仪.每次取粒度为0.074~0.147 mm的煤粉10 mg进行实验.实验过程中,首先将样品在室温25 ℃条件下恒温40 min,以排净热重分析仪加热管内的空气;然后以10 ℃/min加热到105 ℃,恒温10 min,以除去样品中的吸附水;再以不同的升温速率(5、25、45 ℃/min)加热到900 ℃.实验期间用流量为150 mL/min的高纯氮气(≥99.999%)作保护气体.实验数据由计算机自动收集.
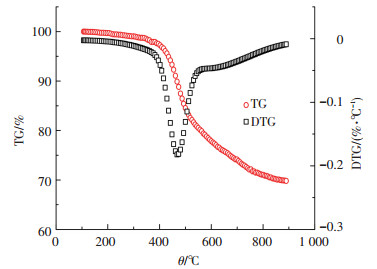
2 结果与讨论 2.1 兴隆庄煤热解实验数据分析将兴隆庄煤在25 ℃/min升温速率下的热解实验数据绘制成曲线如图 1所示.
|
图 1 兴隆庄煤热解过程曲线(25 ℃/min) |
根据图 1中失重(TG)曲线和失重速率(DTG)曲线形状特点,可将兴隆庄煤热解过程分为3个阶段:第1阶段(105~395 ℃),温度较低,失重量少,主要是煤中吸附气体脱除及部分弱键的解聚过程[10];第2阶段(395~518 ℃),主要发生解聚和分解反应,挥发出大量的碳氢化合物,焦油大都在该阶段生成,温度在470 ℃时,TG曲线急速下降,相应DTG曲线达到峰值,热解反应速率达到最大[11];第3阶段(518~900 ℃),TG曲线下降较为缓慢,DTG曲线逐渐上升,失重速率逐渐减小,反应以缩聚反应为主,主要是半焦的进一步焦化,并伴有明显的体积收缩现象[12].
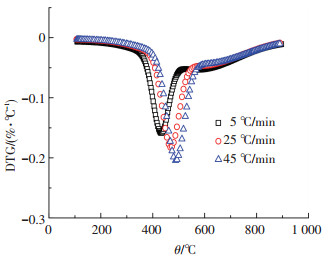
2.2 升温速率对煤热解影响图 2,3分别为兴隆庄煤在不同升温速率(5、25、45 ℃/min)下的热解过程曲线.

|
图 2 不同升温速率(5、25、45 ℃/min)的TG曲线 |
|
图 3 不同升温速率(5、25、45 ℃/min)的DTG曲线 |
从图 2,3可以看出,不同升温速率下的TG曲线形状相似,在同一温度下,升温速率越快,失重率越小.随升温速率增加,DTG曲线达到最低点的温度增大,反应的激烈程度增加.
在第1阶段,TG曲线出现失重坡前,不同升温速率的TG和DTG曲线相差不大,升温速率对其影响较小.在360 ℃后,TG曲线开始出现失重坡,其所对应的温度点随升温速率的提高而增大,即开始发生大量解聚和分解反应的温度升高; 在第2阶段,由不同升温速率的DTG曲线可知,随着升温速率上升,失重速率的峰值变大,且峰值所对应的温度增加,热滞后现象明显; 在第3阶段,失重速率随温度的升高逐渐减小,升温速率对失重速率的影响较小.
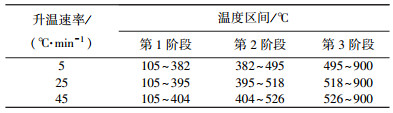
3 分段法研究兴隆庄煤热解过程动力学的应用 3.1 温度区间的划分根据分段法的思想并结合兴隆庄煤热解过程曲线的特点,取失重速率变化最大所对应的温度点,把兴隆庄煤的热解温度区间分为3个阶段,结果见表 2.
| 表 2 不同阶段的温度区间 |
考虑到兴隆庄煤的热解反应过程在不同温度段的控速机理不同,采用单一模型不能很好地描述其整个热解过程.所以,本文对兴隆庄煤热解的过程分段进行了研究.
由兴隆庄煤的TG和DTG曲线分析可知,热解过程的第1阶段,温度较低,少量的气体产物容易从较薄的固体产物层扩散出去,热解过程受界面化学反应控速;第2阶段主要是煤中大分子物质的解聚和分解过程,失重速率明显大于第1阶段,一时产生大量的气体难以排出,热解过程受内扩散控速;第3阶段主要是半焦的进一步焦化,考虑到此过程有明显体积收缩现象,故采用生成物固体体积收缩的内扩散控速模型[13-14].
3.2.1 界面化学反应控速模型模型假设反应颗粒A为球体且致密,反应类型为一级界面化学,化学反应式A(s)=aG(g)+bS(s),从而可得:A物质消耗速率为vA=-dnA/dt=4πr2ρAdr/(MAdt);界面化学反应速率为vC=4πr2krea;当界面化学反应控速时,A物质消耗速率等于界面化学反应速率,即

|
(1) |
式中:MA为物质A的相对分子质量;ρA为A物质的密度,g/m3;r为未反应物质A的半径,m.
将式(1)化简后,积分整理后为
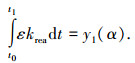
|
(2) |
式中:ε=MA/(ρAR0), y1(α)=1-(1-α)1/3; krea为界面化学反应速率常数;转化率α为反应物A消耗的质量与原始质量之比,α=(R03-r3)/R03;R0为反应物的初始半径,m.
将升温速率关系式dT=βdt,阿累尼乌斯krea=Aexp(-Ea1/RT)带入式(2)积分整理后可得
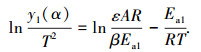
|
(3) |
式中:β为升温速率,K/s;m · s-1;A为指前因子,m · s-1;Ea1为反应活化能,J · mol-1;R为气体常数,J/(K · mol);T为反应温度,K.
根据式(3)给出ln[y1(α)/T2]与1/T的线性关系式,对第1阶段实验数据进行拟合,可得到相应的斜率和截距,进而可求得活化能Ea1和指前因子A.
3.2.2 生成物固体体积不变的内扩散控速模型不考虑固体生成物的体积变化,当生成物气体内扩散为控速环节时,物质A消耗速率vA与气体扩散速率vD1满足关系式vD1=avA,即-4aπr2ρAdr/(MAdt)=4πr2D1dc/dr,积分整理可得
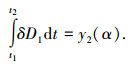
|
(4) |
式中:δ=6MA(ci-c0)/(aρAR02);y2(α)=1-3(1-α)2/3+2(1-α);ci、c0分别为反应界面处和固体外表面处气体G物质的质量分数,mol/m3;D1为有效扩散系数,m2 · s-1;a为化学反应生成气体的化学计量数.
又因为D1=D01exp(-Ea2/RT);dT=βdt;将式(4)积分整理后可得
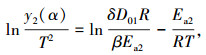
|
(5) |
同理,由式(5)的ln[y2(α)/T2]与1/T线性关系,可求得扩散活化能Ea2和频率因子D01.
3.2.3 生成物固体体积收缩的内扩散控速模型在第3阶段,煤的热解以缩聚反应为主,并伴有明显的体积收缩现象.故采用生成物固体体积收缩的内扩散控速模型,其模型示意如图 4所示.
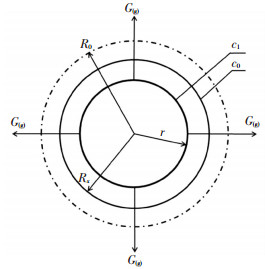
|
图 4 理论模型示意 |
定义V为固体反应物与生成物固体体积之比,V=(Rx3-r3)/(R03-r3),本试验中V=0.679.其中:Rx为某时刻体积改变后的半径,m.
与式(4)类似, 可得
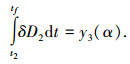
|
(6) |
式中: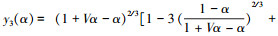
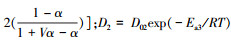
同理可得

|
(7) |
同理,由式(7)的ln[y3(α)/T2]与1/T线性关系,求得扩散活化能Ea3和频率因子D02.
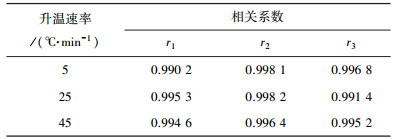
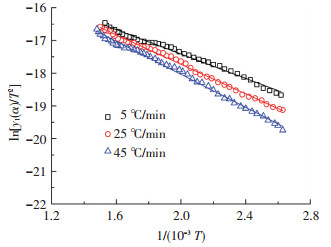
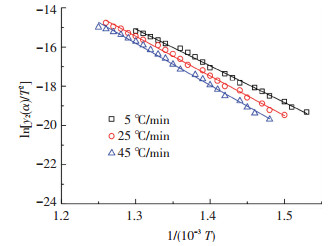
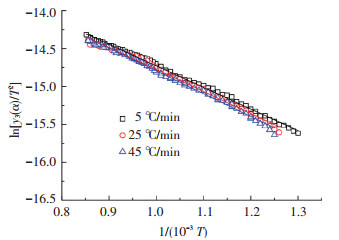
3.3 分段拟合的结果根据表 2中温度区间的划分,用式(3)、式(5)和式(7)分别对不同升温速率下3个阶段的实验点进行拟合,结果如图 5~7所示.表 3为各个拟合结果中的相关系数.
|
图 5 第1阶段模型拟合结果 |
|
图 6 第2阶段模型拟合结果 |
|
图 7 第3阶段模型拟合结果 |
| 表 3 不同升温速率下3个阶段拟合的相关系数 |
由图 5~7及表 3可知,实验点与模型拟合的线性关系很好,拟合后的相关系数全部都在0.99以上,表明所建立的动力学模型能很好地描述对兴隆庄煤热解过程的3个阶段.
3.4 动力学参数的计算根据图 5~7中的拟合结果及相关参数,可计算出不同条件下相关动力学参数,结果见表 4~6.其中:MA=106;R0=1.11×10-4 m;a=1;ρA=1.28×106 g/m3;ci=1 mol/m3;c0=0 mol/m3.
| 表 4 第1阶段热解动力学参数 |
| 表 5 第2阶段热解动力学参数 |
| 表 6 第3阶段热解动力学参数 |
由表 4~6可知,同一阶段的活化能随升温速率的增加而增大.第1阶段的活化能最小,在15~21 kJ/mol内,该阶段主是表面吸附气体脱除及弱键解聚的过程,所需能量较低;第2阶段活化能最大,在158~179 kJ/mol之间,此阶段为煤中高分子裂解及大量的裂解气体产物的扩散排出的主要阶段,所需能量较高;第3阶段活化能在23~25 kJ/mol之间,其变化的幅度最小,主要是半焦进一步焦化的过程.
根据温度区间的划分,将不同的温度点分别带入表 4~6中对应的化学反应速率常数(krea),有效扩散系数(D1)和有效扩散系数(D2)中,可得到不同温度下的相关动力学参数.将其取对数后,进行比较,如图 8所示.
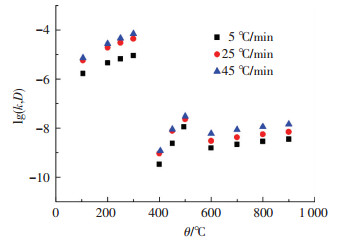
|
图 8 不同温度下相关动力学参数 |
由图 8可知,第1阶段中的化学反应速率常数k的数量级(10-6~10-4)要比第2、3阶段中的有效扩散系数D(10-10~10-8)高出3~4个数量级,这与国内、外学者测定的k和D的数量级相符[15].k和D随温度和升温速率的提高而变大.在第3阶段,受高温下体积收缩的影响,扩散途径会变得复杂,故随温度的升高,有效扩散系数的增加较为缓慢.
4 结论1) 随升温速率的提高,兴隆庄煤的整个热解过程会出现明显的“热滞后现象”.取失重速率变化最大所对应的温度点,把其热解温度区间分为3个阶段:第1阶段,主要是吸附气体脱除及弱键解聚过程;第2阶段,主要发生解聚和分解反应,挥发出大量的碳氢化合物,焦油大量生成,煤逐步黏结形成半焦;第3阶段,主要是半焦进一步焦化的过程.
2) 依据分段法及兴隆庄煤热解的特点,分别建立了不同的动力学模型来对其3个阶段进行拟合,效果很好.并由此计算出了不同阶段的反应速度常数和有效扩散系数与温度的关系式.
3) 分段法研究煤热解过程动力学的方法,还可用于煤的燃烧、气化及其他动力学过程,具有较强的普适性.此外,在模型的建立的过程中由于相应的边界条件及结构参数的引入,所求出的相关动力学参数应用范围更广,为深入研究煤炭的综合利用奠定了基础.
| [1] |
刘起航, 吴铿, 王洪远, 等. COREX用煤焦油析出动力学研究[J]. 煤炭学报, 2012, 37(10): 1749-1752. |
| [2] |
许桂英, PAULW A, NAOKOE, 等. 亚麻纤维热解动力学的" model free"法和Coats-Redfern模型拟合法研究[J]. 化工学报, 2010, 61(9): 2480-2487. |
| [3] |
TANG Wanjun, WANG Cunxin, CHEN Donghua. Kinetic studies on the pyrolysis of chitin and chitosan[J]. Polymer Degradation and Stability, 2005, 87(3): 389-394. DOI:10.1016/j.polymdegradstab.2004.08.006 |
| [4] |
MIURA K C, MAKI T S. A simple method for estimating f(E) and k0(E) in the distributed activation energy model[J]. Energy & Fuels, 1998, 12(5): 864-869. |
| [5] |
刘旭光, 李保庆. 分布活化能模型的理论分析及其在半焦气化和模拟蒸馏体系中的应用[J]. 燃料化学学报, 2001, 29(1): 54-59. |
| [6] |
CELAYA A M, LADE A T, GOLDFARB J L, et al. Co-combustion of brewer's spent grains and Illinois No.6 coal:Impact of blend ratio on pyrolysis and oxidation behavior[J]. Fuel Processing Technology, 2015, 129: 39-51. DOI:10.1016/j.fuproc.2014.08.004 |
| [7] |
ZHANG Jianliang, WANG Guangwei, SHAO Jiugang, et al. A modified random pore model for the kinetics of char gasification[J]. BioResource, 2014, 9(2): 3497-3507. |
| [8] |
JEONG H M, SEO MW, JEONG S M, et al. Pyrolysis kinetics of coking coal mixed with biomass under non-isothermal and isothermal conditions[J]. Bioresource Technology, 2014, 155: 442-445. DOI:10.1016/j.biortech.2014.01.005 |
| [9] |
ABOYADE A O, GÖRGENS J F, CARRIER M, et al. Thermogravimetric study of the pyrolysis characteristics and kinetics of coal blends with corn and sugarcane residues[J]. Fuel Processing Technology, 2013, 106: 310-320. DOI:10.1016/j.fuproc.2012.08.014 |
| [10] |
崔银萍, 秦玲丽, 杜娟, 等. 煤热解产物的组成及其影响因素分析[J]. 煤化工, 2007(2): 10-15. |
| [11] |
ZHANG Yuming, WANG Yin, CAI Lianguo, et al. Dual bed pyrolysis gasification of coal:Process analysis and pilot test[J]. Fuel, 2013, 112: 624-634. DOI:10.1016/j.fuel.2012.01.038 |
| [12] |
FU Zhixin, GUO Zhancheng, YUAN Zhangfu, et al. Swelling and shrinkage behavior of raw and processed coals during pyrolysis[J]. Fuel, 2007, 86(3): 418-425. DOI:10.1016/j.fuel.2006.07.017 |
| [13] |
郭汉杰. 冶金物理化学[M]. 北京: 冶金工业出版社, 2006: 114-126.
|
| [14] |
MAITRA S, BANDYOPADHYAY N, DAS S, et al. Non-Isothermal decomposition kinetics of alkaline earth metal carbonates[J]. Journal of the American Ceramic Socity, 2007, 90(4): 1299-1303. DOI:10.1111/jace.2007.90.issue-4 |
| [15] |
FERRARA F, ORSINI A, PLAISANT A, et al. Pyrolysis of coal, biomass and their blends:performance assessment by thermogravimetric analysis[J]. Bioresource Technology, 2014, 171: 433-441. DOI:10.1016/j.biortech.2014.08.104 |
 2016, Vol. 48
2016, Vol. 48