超滤膜作为城市净水技术,由于其截留悬浮物、细菌、病毒及出水水质等方面优于传统工艺,近年来在中国城市净水厂中的应用越来越广[1].膜污染是制约超滤工艺应用的关键因素,因为膜污染与超滤膜系统运行能耗相关联[2].混凝作为膜前预处理中最有效的工艺可改善膜前水质,显著减缓膜污染[3-5].由于絮体受混凝剂种类与投量、颗粒浓度等因素影响,常与无机混凝剂配合使用[6-7].针对高浊水投加助凝剂可减缓膜污染,但投量过大时反而引发膜污染加剧[8].为进一步研究上述现象,本实验通过改变混凝剂及助凝剂的投加,考察其生成絮体颗粒大小的差异,通过膜通量变化分析后续超滤过程中膜污染变化情况,并结合纳米粒度分布以及扫描电镜对膜污染机理进行探究.
1 实验 1.1 实验水质实验用水由自来水、高岭土及腐殖酸(8 mg/L, 天津市光复精细化工研究所)配制而成.其中,自来水在使用前静置24 h,水中余氯经邻联甲苯胺比色法测定由0.2 mg/L降至0 mg/L.腐殖酸母液(2 g/L)配方如下:称取2.0 g腐殖酸溶解于pH为12的NaOH溶液中,置于磁力搅拌器上连续搅拌24 h,用NaOH和HCl溶液将pH调至7.5,离心去除沉淀物后定容于1 L容量瓶中,避光保存于4 ℃冰箱内.混凝剂采用聚合氯化铝(PACl)和三氯化铁(FeCl3),助凝剂采用聚丙烯酰胺(PAM).其中PACl (Al2O3 28%)储备液浓度为0.4 mol/L (以Al3+计);FeCl3储备液质量浓度为0.3 mol/L (以Fe3+计);PAM储备液质量浓度为1 g/L,于4 ℃冰箱内保存.实验期间温度为15~19 ℃,其他水质指标如表 1所示.
| 表 1 原水及出水水质指标 Table 1 Water quality of influent and effluents in coagulation-aid-coagulation systems |
实验采用ZR4-6(深圳中润)搅拌机进行混凝剂(PACl和FeCl3)的絮凝过程.具体操作是将原水加入到1 L的搅拌杯中并分别投加混凝剂PACl (0、2、3、4、6和8 mg/L)及FeCl3(0、2、3、4、6和8 mg/L),同时启动混凝搅拌程序:以200 r/min快速混合1 min,然后以50 r/min慢速搅拌15 min,静沉30 min后于水面下3 cm处取样测定其余浊,并经0.45 μm的微孔滤膜过滤测定其TOC、UV254值.分析上述实验结果,固定混凝剂投量为3 mg/L,进行如上前16 min的混凝搅拌程序,并于混凝开始后的第5分钟投加PAM (0、0.2、0.4、0.5、1.0和1.5 mg/L),测定动态情况下絮体粒径、Zeta电位、余浊、UV254及膜通量变化.
动态絮体粒径大小由马尔文粒度仪(Malvern Mastersizer 2000, 英国)监测.如图 1(a)所示,将1 L实验配水加入到搅拌杯中,加入混凝剂的同时开启混凝程序和蠕动泵,混合液经内径为5 mm的管道由蠕动泵循环送入马尔文粒度仪内进行粒径测量,进水管位于搅拌杯顶端,出水管位于搅拌杯侧面底部,实验中每30 s进行一次粒径测量,数据自动传送并保存于电脑内.其中采用d50表示絮体平均粒径.
实验通过超滤杯装置测定单独投加混凝剂(0、2、3、4、6和8 mg/L)和混凝剂(3 mg/L)及助凝剂(0、0.2、0.4和1.0 mg/L)联合投加时的恒压膜通量.如图 1(b)所示,使用截留分子质量为100 ku的PES (Millipore,美国)平板膜置于超滤杯底部,超滤杯上端连接氮气瓶(保持恒压0.1 MPa),出水用电子天平测定(每5 s记录一个数值).实验开始时依次过滤100 mL超纯水、350 mL混合液及100 mL超纯水,并分别记录其纯水通量J0、过滤通量J和除污染物质后的纯水通量J′0.以J/J0随体积的变化表示膜污染对通量的影响,并通过比阻比较分析,对比不同混凝剂及助凝剂投加情况下的膜阻力差异,进一步判断其对膜污染的影响.
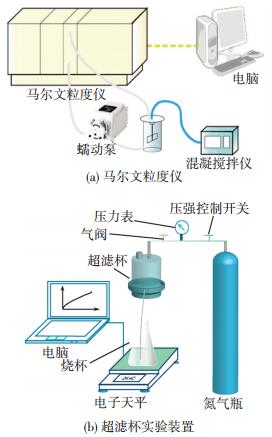
|
图 1 实验装置示意 Figure 1 Schematic diagram of the experimental set-up |
水力阻力(Rt)测定方法应用很广泛[9-10],可以通过下列方式计算:
| $ {R_{\rm{t}}} = {R_{\rm{m}}} + {R_{{\rm{mf}}}} = {R_{\rm{m}}} + {R_{\rm{c}}} + {R_{\rm{f}}} = \frac{{{p_{{\rm{TM}}}}}}{{\mu \cdot{J_{\rm{f}}}}}. $ | (1) |
式中膜的阻力(Rm)可以通过纯水在过滤前测定,即
| $ {R_{\rm{m}}} = \frac{{{p_{{\rm{TM}}}}}}{{{\mu _0}\cdot{J_0}}}. $ | (2) |
式中J0为纯水通量,μ0为纯水的运动黏滞系数.当过滤停止时,膜组件取出,采用海绵轻轻去除膜表面的滤饼.此时,Rf可通过去除滤饼前后阻力的差值得到,即
| $ {R_{\rm{f}}} = {\rm{ }}\frac{{{p_{{\rm{TM}}}}}}{{{\mu _0}\cdot J{'_0}}} - \frac{{{p_{{\rm{TM}}}}}}{{{\mu _0}\cdot{J_0}}} = \frac{{{p_{{\rm{TM}}}}}}{{{\mu _0}\cdot J{'_0}}} - {R_{\rm{m}}}. $ | (3) |
式中J′0为膜去除污染物质后的纯水通量,Rc可通过下列方程计算:
| $ {R_{\rm{c}}} = {R_{\rm{t}}} - {R_{\rm{m}}} - {R_{\rm{f}}}. $ | (4) |
膜污染阻力(Rmf)可以通过下列公式计算:
| $ {R_{{\rm{mf}}}} = {R_{\rm{t}}} - {R_{\rm{m}}}. $ | (5) |
式中:pTM (Pa)为跨膜压差,μ (Pa·s)为水的运动黏滞系数,Rt(m-1)为总阻力,Rm(m-1)为膜的阻力,Rmf(m-1)为膜的污染阻力,Rc(m-1)为滤饼阻力,Rf(m-1)为吸附或堵塞的污染阻力.
1.4 分析仪器与方法浊度:浊度仪(HACH 2100N, 美国);电导率:电导率仪(SevenCompact S230, 瑞士);DOC:TOC仪(multi N/C 2100S, 德国);UV254:紫外/可见分光光度计(T6新世纪, 中国);Zeta电位:Zeta电位仪(Malvern, 英国);Al3+、Fe3+含量:ICP-OES (Varian 700 -ES, 美国),水样测定前经0.45 μm膜过滤;pH:pH计(Sartorius PB-21, 德国);温度:在线温度计.
2 结果与讨论 2.1 混凝剂投量对絮体粒径影响图 2为不同混凝剂不同投量下絮体粒径随时间变化.由图 2(a)可知,当投加PACl 2~4 mg/L时,絮体粒径显著增长时间延后(2 mg/L (1.5~5 min);3 mg/L (2~6 min);4 mg/L (3.5~8 min)),最终稳定时粒径增长显著(3 mg/L以内:3~280 μm;4 mg/L:3~370 μm).当投量为6 mg/L时,絮体颗粒在第8分钟才显著增长,在第15分钟形成稳定絮体且达到只投加PACl时的最大粒径(400 μm).然而,当继续增大投量至8 mg/L时,混凝过程(16 min)结束后絮体粒径仅为80 μm.如图 2(b)所示,当投加FeCl3 2~4 mg/L时,絮体粒径增长时间延后的趋势与图 2(a)一致,不同的是,不同投量下絮体粒径在第6~8分钟后不再增长,且均稳定在360~420 μm.而当投量增至6~8 mg/L时,测得水中颗粒物的粒径与原水相近(约5 μm),可认为并未生成絮体.在pH为7左右时混凝以电中和为主导(表 1中投加混凝剂后Zeta值在0附近),投加适量的铝盐和三价铁盐,其水解产物在混合过程中会吸附微小颗粒物,并使其脱稳絮凝成粒径为几百微米的絮体[11];但投加过量时,胶体会产生再稳现象,不利于絮体形成.投加FeCl3时出水pH低于投加PACl时(表 1),其水解后生成高电荷的羟基多核配合物,同时水中有机物的质子化程度高,因此,更利于有机物吸附到水解产物上[12-13],生成絮体颗粒粒径较投加PACl时大.
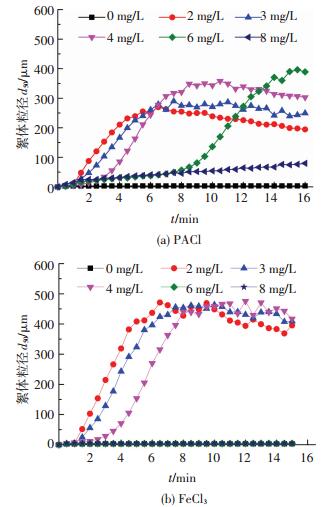
|
图 2 不同混凝剂不同投量下絮体平均粒径随时间的变化 Figure 2 Effect of different coagulants on the formation of aggregates at varied dosage |
对比图 2(a)、(b)可知,投加少量混凝剂(2~4 mg/L)可显著增强混凝效果;但投量过大时混凝延迟或不明显,甚至没有混凝效果.
2.2 助凝剂投量对絮体粒径影响图 3为不同混凝剂对应助凝剂不同投量下絮体粒径分布平均粒径随时间变化.由图 3(a)可知,当PAM投量为0.2 mg/L时,絮体粒径仅由240 μm增至400 μm;投量为0.4~1.0 mg/L时,生成粒径在730~900 μm的大颗粒絮体;继续增大投量至1.5 mg/L时,粒径在680~1 000 μm,可见最终稳定时絮体颗粒大小随PAM投量的增大而显著增长.图 3(b)所示的粒径变化整体趋势与图 3(a)相似,当投量为0.2 mg/L时絮体粒径由430 μm小幅度增长至630 μm;投加0.4~1.0 mg/L时,絮体颗粒迅速增长至800~1 200 μm;高投量情况下(1.5 mg/L),絮体测量数据波动明显,这是因为大颗粒絮体聚集并沉于搅拌杯底部中央位置,难以随管道进入测定腔体而准确测定其粒径大小.
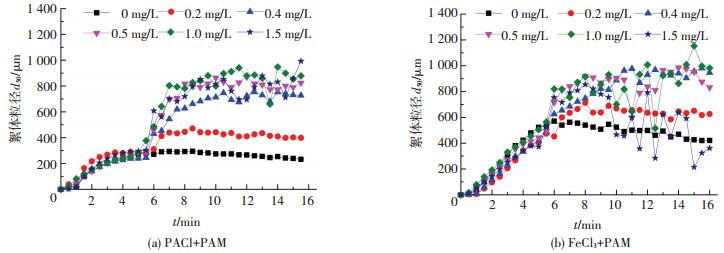
|
图 3 不同混凝剂对应不同投量助凝剂下絮体平均粒径随时间变化 Figure 3 Effect of different coagulants coupled with aid-coagulants on the formation of aggregates at varied dosage |
对比图 3(a)、(b)可知,虽然投加混凝剂种类不同且在投加PAM之前微絮体颗粒大小不同,投加PAM均可达到助凝效果,且投加PAM的3 min内絮体粒径显著增长并未发生破碎现象,可见PAM助凝效果迅速、显著且稳定.PAM水解后形成长链的高分子物质,通过吸附架桥作用链结絮体颗粒,当PAM投量较少时,微絮体颗粒链结不完全,因而颗粒仅有小幅度增长[8].
2.3 混凝剂投量对膜污染的影响图 4为不同混凝剂在不同投量时比通量与膜阻力大小.如图 4(a)所示,在大投量6~8 mg/L时,比通量(0.331~0.332)明显小于2~4 mg/L时(0.591~0.708),但均远大于原水直接过滤时(0.148).由图 4(b)可知,FeCl3在小投量2~4 mg/L时比通量增大明显,由0.508增至0.593;6 mg/L时比通量明显减小仅为0.419;而当投量增大为8 mg/L时仅为0.100,甚至小于原水时(0.148).
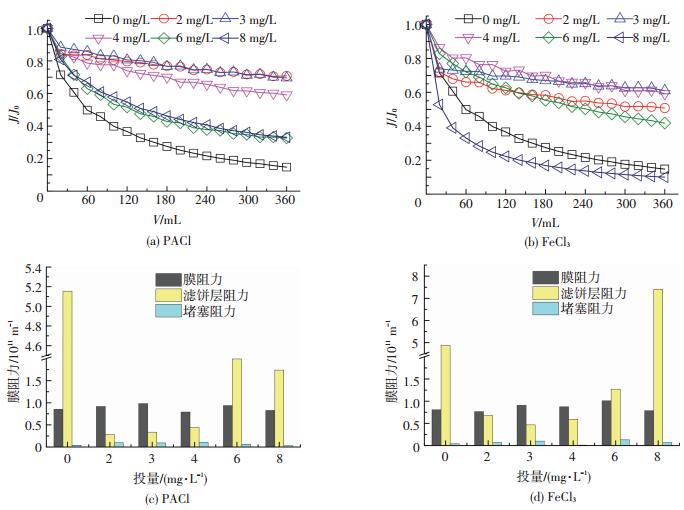
|
图 4 不同混凝剂不同投量时比通量及膜阻力大小 Figure 4 Flux and membrane filtration resistance under different coagulants at varied dosage |
由图 4(c)、(d)可知,影响膜通量的几个因素中滤饼层阻力变化最大,堵塞阻力无显著差异且其最大值仍不超过0.1×10-11m-1,可认为其并不是影响膜通量的主要因素.原水直接过滤时滤饼层阻力为5.15×10-11 m-1,此时膜阻力和堵塞阻力仅为0.85×10-11和0.04×10-11 m-1.由图 4(c)可知,投加PACl 2~8 mg/L时滤饼层阻力(0.28×10-11~1.99×10-11m-1)均小于原水直接过滤时,而投量在2~4 mg/L时滤饼层阻力远小于其他情况.图 4(d)表明,FeCl3投量在2~6 mg/L时的滤饼层阻力与PACl相似,范围为0.59×10-11~1.27×10-11 m-1均远小于原水直接过滤对应值;而当投量过高达8 mg/L时,滤饼层阻力为7.41×10-11 m-1远远大于原水直接过滤时.在混凝过程中,腐殖质通过与带正电的金属盐混凝剂中和,或者被金属氢氧化物吸附而去除[14].随混凝剂的投加Zeta值上升而pH下降(表 1),当混凝剂投加过量时,低pH抑制其水解并使胶体再稳,导致水中小颗粒物质含量增高而显著提升膜阻力[15],且当FeCl3投量过高时,混凝沉淀后余浊(107)甚至高于原水浊度(103).综合图 2和4,在较小投量(2~4 mg/L)下,絮体粒径、比通量均大于大投量(6~8 mg/L)时,但其滤饼层阻力却小于后者.
这与Feng[16]及Ma[17]等的研究结果相似,以Al盐和Fe盐作为混凝剂,在电中和情况下投量不足会导致腐殖酸去除率较低并产生更多的小颗粒,滤饼层阻力增大;投量过高时混凝剂的水解产物又会直接造成滤饼层阻力增加的结论相符,也可证实Zhang等[18-20]推测认为滤饼层是产生膜污染的主要原因.
2.4 助凝剂投量对膜污染的影响图 5为不同PAM投量时比通量及膜阻力大小.由图 5(a)可知,当投加PAM 0.2~0.4 mg/L比通量分别增长至0.562和0.641;而提高投量到1.0 mg/L时,比通量(0.475)甚至小于未投加PAM时;由图 5(b)表明,投加PAM 0.2~0.4 mg/L时比通量分别为0.709和0.764,均高于未投加PAM时比通量(0.685);继续增大投量至1.0 mg/L时比通量值明显降低(仅0.585).

|
图 5 不同投量PAM时比通量和膜阻力大小 Figure 5 Flux and membrane filtration resistance with varied PAM dosage |
由图 5(c)可知,未投加PAM时滤饼层阻力为0.90×10-11 m-1,此时堵塞阻力为0.08×10-11 m-1;PAM投量为0.2~0.4 mg/L时,滤饼层阻力分别下降至0.66×10-11和0.52×10-11 m-1,此时堵塞阻力并没有显著变化;当投量增至1.0 mg/L时,滤饼层阻力和堵塞阻力显著增长至1.55×10-11和0.42×10-11 m-1,其中堵塞阻力甚至是未投加PAM时的5倍.由图 5(d)可见,混凝剂为FeCl3时膜阻力情况与PACl相似,未投加PAM时滤饼层阻力为0.47×10-11 m-1,堵塞阻力为0.11×10-11 m-1;投加0.2~0.4 mg/L时的滤饼层阻力分别降至0.35×10-11和0.28×10-11 m-1,堵塞阻力分别为0.18×10-11及0.08×10-11 m-1;当投量高达1.0 mg/L时,滤饼层阻力增至0.62×10-11 m-1,堵塞阻力也增加到0.24×10-11 m-1.
虽然混凝剂种类不同,投加PAM均在小投量0.2~0.4 mg/L时比通量随投量的增大而升高,滤饼层阻力随投量增大而减小;而高投量1.0 mg/L对应滤饼层阻力和堵塞阻力急剧增大.Guo等[21]在之前的研究中也发现PAM投量增大而膜污染显著加剧的现象.这可能有以下几种原因:一方面由于PAM水解后碳链上的活性基团与高岭土颗粒产生专性吸附而形成无定形松散絮体[22],而PAM分子中高活性的酰胺基(CONH2)水解,加强了絮凝效果[23],此时测得Zeta值下降、pH上升,同时絮体粒径增长显著(图 3). PAM分子浓度过高时,高岭土颗粒表面聚合物分子过饱和而引发膜污染加剧;另一方面水中无机纳米粒度颗粒(高岭土)会改变膜表面活化能,使膜孔易于堵塞[22];此外Li等[24]的研究也表明高投量下PAM分子会促进絮体在膜表面的聚集和叠加.
2.5 膜污染机理讨论膜污染主要由水中的颗粒物、有机物和微生物引起,其中颗粒物会形成滤饼层并导致膜孔堵塞[25-26].当颗粒尺寸小于膜孔尺寸时,污染物会沉积于膜孔壁上使膜孔收缩;颗粒尺寸较大时则沉积于膜表面而形成滤饼层[26];当颗粒尺寸与膜孔大小相近时会形成膜孔堵塞而引发严重的膜污染[8].为了探究本实验膜污染机理,采用纳米粒度仪进行膜前颗粒表征.图 6为经0.45 μm膜过滤后出水的纳米粒度分布,可见原水在过滤后的粒度约为100 nm,在投加混凝剂及助凝剂后其粒度(3 nm)远小于超滤膜的膜孔径(约10 nm).结合表 1测得混凝或混凝-助凝后DOC和UV254去除率分别为45.6%、70.6%和83.9%、85.0%,认为混凝过程可以去除水中部分有机物,但仍有残余的腐殖酸可能会穿过膜孔.同时,Ma等[27]认为混凝剂存在临界投量,投量过多会引发纳米粒度的微絮体生长而堵塞膜孔,这也可以解释图 4和5中混凝剂及PAM投量达到一定值而继续增加时膜污染加剧现象.
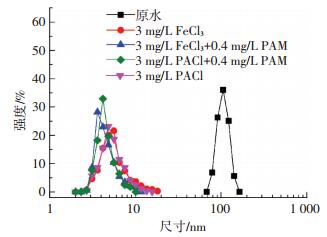
|
图 6 出水经0.45 μm膜过滤后纳米粒度分布 Figure 6 Nano particle size distribution of effluents through a 0.45 μm cellulose acetate membrane |
由图 7的扫描电镜表征可以看出,当原水直接过滤时(图 7(b))高岭土颗粒未形成絮体,因而颗粒散碎均匀地分布在膜表面且不团聚,在膜表面形成了致密的滤饼层而导致膜通量下降迅速(图 4).对比图 7(c)、(f)可知明显形成了由小颗粒聚集而成的具有松散结构的絮体;由图 7(d)、(e)、(g)和(h)可知,投加PAM 0.4 mg/L,絮体颗粒进一步增大同时膜孔并未被堵塞;而投加PAM 1.0 mg/L,絮体颗粒虽进一步增大但膜孔被堵塞,这和膜通量数据变化的结果(图 2、3和4)一致.

|
图 7 扫描电镜表征 Figure 7 SEM images of membrane surface |
综上,超滤膜在混凝-超滤过程和混凝-助凝-超滤过程中膜污染机理如图 8所示.首先,部分小分子有机物由于粒度小可穿过膜孔(图 6).在混凝-超滤过程中(图 8(a)),混凝形成的絮体沉积在膜表面上形成滤饼层(图 7),而膜孔堵塞小(图 4(c)、(d)).在混凝-助凝-超滤过程中(图 8(b)),PAM水解后将更多小颗粒通过吸附架桥作用絮凝成大的松散絮体(图 7),投量小时,膜孔堵塞小,投量大时膜孔堵塞严重, 但滤饼堵塞仍是主要污染(图 4(c)、(d)).
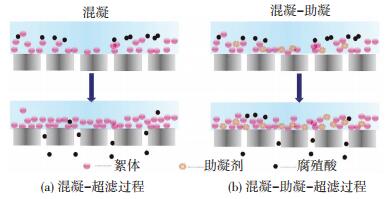
|
图 8 超滤膜污染生成机理 Figure 8 Schematic diagram of membrane fouling mechanism |
1) 投加混凝剂通过生成粒径较大的絮体而去除原水中颗粒物质和有机物,而混凝剂种类和投量对絮体的生成有显著影响.
2) 混凝-助凝-超滤工艺可以明显强化混凝效果,且助凝剂的投量对后续膜污染有显著影响,投量过多或过少均无法缓解、甚至加剧膜污染.
3) 滤饼层阻力是形成膜污染的主要原因,投加适量的混凝剂和助凝剂联用可大幅度减少滤饼层阻力,但助凝剂投加过量可能引起严重的膜孔堵塞而加剧膜污染.
| [1] | XIA S, LI X, ZHANG Q, et al. Ultrafiltration of surface water with coagulation pretreatment by streaming current control[J]. Desalination, 2007, 204 (1/2/3) : 351-358. |
| [2] | XU W, YUE Q, GAO B, et al. Impacts of organic coagulant aid on purification performance and membrane fouling of coagulation/ultrafiltration hybrid process with different Al-based coagulants[J]. Desalination, 2015, 363 : 126-133. DOI: 10.1016/j.desal.2014.11.003 |
| [3] | PEIRIS R H, JAKLEWICZ M, BUDMAN H, et al. Assessing the role of feed water constituents in irreversible membrane fouling of pilot-scale ultrafiltration drinking water treatment systems[J]. Water Research, 2013, 47 (10) : 3364-3374. DOI: 10.1016/j.watres.2013.03.015 |
| [4] | WRAY H E, ANDREWS R C, BERUBE P R. Ultrafiltration organic fouling control: Comparison of air-sparging and coagulation[J]. Journal-American Water Works Association, 2014, 106 (2) : 41-42. |
| [5] | KONIECZNY K, RAJCA M, BODZEK M, et al. Water treatment using hybrid method of coagulation and low-pressure membrane filtration[J]. Environment Protection Engineering, 2009, 35 (1) : 5-22. |
| [6] | WANG S, LIU C, LI Q. Fouling of microfiltration membranes by organic polymer coagulants and flocculants: Controlling factors and mechanisms[J]. Water Research, 2011, 45 (1) : 357-365. DOI: 10.1016/j.watres.2010.08.009 |
| [7] | STOLLER M. On the effect of flocculation as pretreatment process and particle size distribution for membrane fouling reduction[J]. Desalination, 2009, 240 (1) : 209-217. |
| [8] | YU W Z, LIU H J, XU L, et al. The pre-treatment of submerged ultrafiltration membrane by coagulation:Effect of polyacrylamide as a coagulant aid[J]. Journal of Membrane Science, 2013, 446 : 50-58. DOI: 10.1016/j.memsci.2013.06.012 |
| [9] | LIU Y, HE G, LI B, et al. A comparison of cake properties in traditional and turbulence promoter assisted microfiltration of particulate suspensions[J]. Water Res, 2012, 46 (8) : 2535-2544. DOI: 10.1016/j.watres.2012.02.002 |
| [10] | BAI L, QU F, LIANG H, et al. Membrane fouling during ultrafiltration (UF) of surface water: Effects of sludge discharge interval (SDI)[J]. Desalination, 2013, 319 : 18-24. DOI: 10.1016/j.desal.2013.04.004 |
| [11] | YU W Z, GREGORY J, GRAHAM N. Regrowth of broken hydroxide flocs: effect of added fluoride[J]. Environmental Science & Technology, 2016, 50 (4) : 1828-1833. |
| [12] | GAO B, LIU B, CHEN T, et al. Effect of aging period on the characteristics and coagulation behavior of polyferric chloride and polyferric chloride-polyamine composite coagulant for synthetic dying wastewater treatment[J]. Journal of Hazardous Materials, 2011, 187 (1) : 413-420. |
| [13] | MATILAINEN A, VEPS L, INEN M, et al. Natural organic matter removal by coagulation during drinking water treatment: A review[J]. Advances in Colloid and Interface Science, 2010, 159 (2) : 189-197. DOI: 10.1016/j.cis.2010.06.007 |
| [14] | LIU H, HU C, ZHAO H, et al. Coagulation of humic acid by PACl with high content of Al13: The role of aluminum speciation[J]. Separation and Purification Technology, 2009, 70 (2) : 225-230. DOI: 10.1016/j.seppur.2009.09.020 |
| [15] | ZHAO B, WANG D, LI T, et al. Influence of floc structure on coagulation-microfiltration performance: Effect of Al speciation characteristics of PACls[J]. Separation and Purification Technology, 2010, 72 (1) : 22-27. DOI: 10.1016/j.seppur.2009.12.023 |
| [16] | FENG L, ZHAO S, SUN S, et al. Effect of pH with different purified aluminum species on coagulation performance and membrane fouling in coagulation/ultrafiltration process[J]. Journal of Hazardous Materials, 2015, 300 : 67-74. DOI: 10.1016/j.jhazmat.2015.06.034 |
| [17] | MA B, YU W, LIU H, et al. Comparison of iron (III) and alum salt on ultrafiltration membrane fouling by alginate[J]. Desalination, 2014, 354 : 153-159. DOI: 10.1016/j.desal.2014.10.003 |
| [18] | DIZGE N, KOSEOGLU-IMER D Y, KARAGUNDUZ A, et al. Effects of cationic polyelectrolyte on filterability and fouling reduction of submerged membrane bioreactor (MBR)[J]. Journal of Membrane Science, 2011, 377 (1/2) : 1751-1781. |
| [19] | ZHANG M, PENG W, CHEN J, et al. A new insight into membrane fouling mechanism in submerged membrane bioreactor: Osmotic pressure during cake layer filtration[J]. Water Research, 2013, 47 (8) : 2777-2786. DOI: 10.1016/j.watres.2013.02.041 |
| [20] | LIN H J, XIE K, MAHENDRAN B, et al. Sludge properties and their effects on membrane fouling in submerged anaerobic membrane bioreactors (SAnMBRs)[J]. Water Research, 2009, 43 (15) : 3827-3837. DOI: 10.1016/j.watres.2009.05.025 |
| [21] | GUO H, XIAO L, YU S, et al. Analysis of anion exchange membrane fouling mechanism caused by anion polyacrylamide in electrodialysis[J]. Desalination, 2014, 346 : 46-53. DOI: 10.1016/j.desal.2014.05.010 |
| [22] | YI X S, SHI W X, YU S L, et al. Comparative study of anion polyacrylamide (APAM) adsorption-related fouling of a PVDF UF membrane and a modified PVDF UF membrane[J]. Desalination, 2012, 286 : 254-262. DOI: 10.1016/j.desal.2011.11.032 |
| [23] | YUAN S J, SUN M, SHENG G P, et al. Identification of key constituents and structure of the extracellular polymeric substances excreted by Bacillus megaterium TF10 for their flocculation capacity[J]. Environmental Science & Technology, 2010, 45 (3) : 1152-1157. |
| [24] | LI J, WU J, SUN H, et al. Advanced treatment of biologically treated coking wastewater by membrane distillation coupled with pre-coagulation[J]. Desalination, 2016, 380 : 43-51. DOI: 10.1016/j.desal.2015.11.020 |
| [25] | GAO W, LIANG H, MA J, et al. Membrane fouling control in ultrafiltration technology for drinking water production: A review[J]. Desalination, 2011, 272 (1/2/3) : 1-8. |
| [26] | IRITANI E. A review on modeling of pore-blocking behaviors of membranes during pressurized membrane filtration[J]. Drying Technology, 2013, 31 (2) : 146-162. DOI: 10.1080/07373937.2012.683123 |
| [27] | MA B, YU W Z, LIU H J, et al. Effect of low dosage of coagulant on the ultrafiltration membrane performance in feedwater treatment[J]. Water Research, 2014, 51 : 277-283. DOI: 10.1016/j.watres.2013.10.069 |
 2017, Vol. 49
2017, Vol. 49


