近年来, 超滤膜已经广泛应用于污水处理和深度资源化回用领域[1-4], 但膜污染仍然是限制膜分离技术在水处理领域推广应用的主要因素[5-6].而废水中大量存在的蛋白质是引起膜污染的主要物质之一[7-8].蛋白质的膜污染行为受到诸多因素的影响, 而废水中广泛存在的无机阳离子是影响其膜污染的主导因素之一.但是, 既往关于无机阳离子对蛋白质膜污染影响的研究, 并没有得到统一的认识或结论.多数结果表明, 蛋白质污染随离子强度增加而加剧.主要通过DLVO理论解释此现象.即随着离子含量增加, 膜-蛋白质及蛋白质-蛋白质之间的静电排斥力减小, 从而加剧膜污染[9-10].但是, 另外一些研究者发现, 随着离子强度的增大, 蛋白质膜污染幅度明显减缓, 与DLVO理论恰恰相反[4, 11-12].而关于膜污染减缓的原因多是基于宏观膜通量变化而给出的一些推测性解释.
近来, 本研究小组从微观层面深入考察了不同Na+离子浓度下牛血清蛋白在超滤膜界面的作用过程, 结果证实[7, 13],当Na+浓度达到一定值后, 水合排斥力的出现削弱膜-蛋白及蛋白与蛋白之间的作用力, 导致蛋白质在膜界面的吸附累积速率减缓, 是引起膜污染减轻的本质原因.水合作用力是一种典型的短程排斥力[14-15], 其主要是因为Na+、K+及Mg2+等水合阳离子, 导致膜及污染物表面形成特定结构的水合层, 进而触发二者之间的水合排斥力.水合排斥力的存在, 可削弱膜-污染物及污染物之间的相互作用力, 进而减缓膜污染.但是, 目前在膜污染领域, 关于水合作用的研究鲜有报道, 主要是因为只有当pH、离子及固体界面性质等外界因素满足适对的条件, 才能有效触发水合作用力.
综上, 在既往研究的基础上, 进一步探明超滤过程水合排斥力的作用行为及其关键控制因素, 对利用水合作用减缓膜污染至关重要.本研究选用牛血清蛋白(BSA)代表水中蛋白类污染物, 并采用典型一价水合阳离子Na+, 通过原子力显微镜(AFM)结合BSA胶体探针, 考察BSA不同带电性能条件下, 膜-BSA及BSA-BSA之间的作用力随离子强度的变化特征, 结合相应条件下BSA的Zeta电位, 解析BSA带电性对超滤过程水合作用力的影响机制.
1 实验 1.1 污染物污染物溶液:牛血清蛋白(BSA, Sigma-Aldrich, St.Louis, Mo, Mw=6.7 ku).配置20 mg/L的BSA溶液进行试验.通过NaOH及HCl调节BSA溶液的pH, 进而控制BSA的带电性.采用1 mol/L NaCl溶液调节BSA溶液的离子强度.
采用Zeta电位仪(ZS90Zetasizer, Malvern, England)进行各pH及离子条件下BSA分子Zeta电位的测定.
1.2 PVDF超滤膜的制备膜材料:聚偏氟乙烯(PVDF, Solvay Advanced Polymers Co., Solef 1015);聚乙烯吡咯烷酮(PVP K30, 分析纯, 天津科密欧化学试剂有限公司); N, N-二甲基乙酰胺(DMAc, 分析纯, 天津福晨化学试剂厂).
采用浸没沉淀相转化法制备平板PVDF超滤膜:将PVDF、PVP按照一定比例混溶于DMAc中, 恒温搅拌12 h得到均质铸膜液, 静置脱泡后, 均匀涂覆于玻璃板上, 分相得到PVDF超滤膜, 经充分漂洗后待用.所制备PVDF超滤膜亲水性接触角为72°, 表面Zeta电位为-47 mV.
1.3 BSA污染层制备及膜通量试验采用死端超滤杯系统进行BSA污染层的制备.将平衡后的PVDF超滤膜, 在0.1 MPa下持续过滤特定水质的BSA污染物溶液, 至膜通量稳定, 此时膜面形成稳定的BSA污染层.试验结束后将污染膜置于相应污染物溶液中, 待作用力测定使用.
1.4 BSA胶体探针的制备为了实现PVDF超滤膜与BSA及BSA之间相互作用力的测试, 首先制备了BSA胶体探针,方法如下:在自行搭建三维操作台及光学显微镜辅助下, 首先在AFM无针尖探针微悬臂自由端黏附适量环氧树脂光学胶(Epo Tek公司), 其次通过光学胶将BSA微球(3 μm, GmbH, Germany)黏附于微悬臂自由端, 最后将黏附有BSA微球的探针置于4 ℃冰柜中静置固化一周以上待用.图 1为3 μm BSA胶体探针SEM图.

|
图 1 3 μm的BSA胶体探针SEM图 Figure 1 SEM image of 3 μm BSA colloidal probe |
使用Multimode 8.0原子力显微镜(AFM, Bruker, Germany)结合自行制备BSA胶体探针, 定量测量特定pH及离子条件下PVDF超滤膜-BSA以及BSA-BSA之间的作用力.
AFM作用力测定:首先将BSA胶体探针安装于AFM作用力测试系统中, 并在“接触”模式和相应的液体环境下校正其灵敏度与弹性系数; 其后将样品(干净的PVDF超滤膜或者BSA污染层)固定于作用力测试系统中, 用测试溶液冲洗测试回路, 充满测试液体池; 随后设定参数, 在“接触”模式和相应pH及离子条件的测试环境下进行作用力测定.为减小实验误差, 每个样品随机选取10个不同测试点, 每个测试点重复测试10次, 剔除离奇数据后取平均值进行数据分析, 作用力大小以数据绝对值表示,负号表示测量时探针向下方弯曲.胶体探针使用前后进行完整性检测.
2 结果与讨论 2.1 不同pH下BSA带电性能随离子强度的变化表 1为pH为3.0、4.7及9.0时, BSA的Zeta电位随离子强度的变化特征.可以看出:在所考察的离子强度范围内, pH为3时, BSA始终带有正电荷;而pH为9时, BSA始终带有负电荷;在pH为4.7, 即BSA等电点, BSA带有少量负电荷, 特别是离子强度达到100 mmol/L时, BSA净电荷量几乎趋于0.
| 表 1 不同pH条件下BSA表面的Zeta电位随离子强度的变化 Table 1 Change characters of BSA surface Zeta potential with ionic strengths under different pH conditions |
此外, 无论是BSA带正电、负电还是在BSA等电点, 随着离子强度的增大, BSA所带净电荷量都是逐渐减小.主要是因为随着离子强度的增大, BSA溶液中抗衡离子引起的静电屏蔽及压缩双电层效应逐渐增强, 导致BSA表面所带净电荷量逐渐减小.
2.2 BSA带正电条件下膜污染微观作用力随离子强度的变化首先考察了pH为3, 即BSA带正电条件下, PVDF-BSA及BSA-BSA之间的相互作用力随离子强度的变化特征, 相应典型作用力曲线见图 2.当离子强度为0、1、10及100 mmol/L时, 膜通量衰减率分别为56.42%、60.05%、68.37%、81.09%.可以看出, 膜通量衰减率随离子强度的增大而增大, 即膜污染随离子强度的增大而加剧.而相应条件下PVDF-BSA之间的平均作用力分别为12.7、12.2、12.0、10.1 mN/m, BSA-BSA之间的平均作用力分别为0.33、0.53、0.67、0.93 mN/m, 由PVDF-BSA及BSA-BSA之间的相互作用力随离子强度的变化特征可以看出:

|
图 2 BSA带正电条件下PVDF-BSA及BSA-BSA之间的典型作用力曲线随离子强度的变化 Figure 2 Representative normalized interaction forces versus characteristics of PVDF-BSA and BSA-BSA at different ionic strengths and positive charge of BSA |
1) 针对PVDF-BSA之间的作用力, 随离子强度的增大, PVDF-BSA之间的作用力呈现逐渐减小的趋势.这主要是因为, 在pH为3.0时, BSA呈正电性, 而PVDF超滤膜呈负电性, PVDF-BSA之间存在的是静电吸引力.而静电作用力的大小与PVDF及BSA表面所带净电荷量呈正比关系.随着离子强度的增大, 电荷屏蔽及压缩双电层效应导致PVDF及BSA所带净电荷量逐渐减小, 相应PVDF-BSA之间的静电吸引力逐渐减小, 最终体现为PVDF-BSA之间的相互作用力随离子强度的增大而减小.
2) 针对BSA-BSA之间的作用力, 随离子强度的增大, 其变化规律与PVDF-BSA之间作用力的变化恰好相反, 即BSA-BSA之间作用力随离子强度的增大而增大.同样是由静电作用力的变化引起.随离子强度的增大, 削弱了BSA-BSA之间的静电排斥力, 进而导致BSA-BSA之间的综合作用力随离子强度的增大而增大, 膜污染随离子强度的增大而加剧.
3) 综上, 当BSA带正电荷时, 随着离子强度的增大, 膜污染加剧, PVDF-BSA及BSA-BSA之间的作用力完全遵循DLVO理论, 即静电作用力的变化是控制膜污染微观作用力的主导作用, 并无水合现象出现.这是因为BSA在正电条件下, 其表面吸附的是阴离子Cl-, 而Cl-离子无水合性能, BSA表面并不能形成特定结构的水合层, 因此,并不能触发水合作用力.
2.3 BSA在等电点条件下膜污染微观作用力随离子强度的变化在BSA等电点, 不同离子强度下PVDF-BSA及BSA-BSA之间典型作用力曲线见图 3.当离子强度为0、1、10及100 mmol/L时, PVDF-BSA之间的平均作用力分别为3.2、3.4、2.3、1.3 mN/m, BSA-BSA之间的平均作用力分别为4.2、7.1、4.9、0.9 mN/m, 膜通量衰减率分别为87.62%、92.06%、85.46%、77.88%.显然, 在BSA等电点, 无论是PVDF-BSA、BSA-BSA之间作用力, 还是膜通量衰减率, 随离子强度的增大皆呈现先增大后减小的趋势, 该现象并不能采用DLVO理论解释.
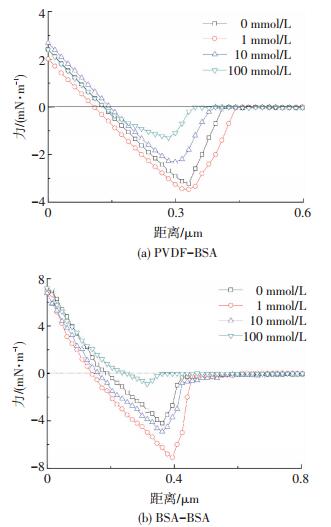
|
图 3 BSA电中性条件下PVDF-BSA及BSA-BSA之间的典型作用力曲线随离子强度的变化 Figure 3 Representative normalized interaction forces versus characteristics of PVDF-BSA and BSA-BSA at different ionic strengths and neutral charge of BSA |
当离子强度为0~1 mmol/L内时, PVDF-BSA与BSA-BSA之间的作用力及膜通量衰减率均随离子强度的增大而增大.这与pH为3条件下, 膜污染微观作用力随离子强度的变化特征相似.这主要是因为在BSA等电点, PVDF超滤膜表面仍然带负电荷, 而BSA表面带有少量负电荷, 随着离子强度从0增大到1 mmol/L, 电荷屏蔽作用导致PVDF-BSA及BSA-BSA间静电排斥力减小, 而PVDF及BSA表面水合Na+的吸附累积量较少, 并不能观测到水合作用力, 最终致使PVDF-BSA及BSA-BSA之间作用力增大, 膜污染加剧.
随着离子强度继续从1增加到10及100 mmol/L, PVDF-BSA与BSA-BSA之间的作用力及膜通量衰减率却随离子强度的增大而逐渐减小.而此时BSA净电荷量逐渐趋于0, 即PVDF-BSA及BSA之间的静电作用力几乎可忽略.但是, 随着离子强度增加, PVDF超滤膜及BSA表面吸附累积的水合Na+离子量逐渐增大, 有效触发了水合作用力[16-18], 进而削弱了PVDF-BSA及BSA-BSA之间的作用力, 减缓膜污染.
综上, 在BSA等电点, 静电作用力及水合排斥力皆是控制膜污染微观作用力的主要因素.较低离子强度条件下, 静电作用力的变化仍然是控制PVDF-BSA及BSA-BSA之间相互作用力的主导因素.当离子强度大于1 mmol/L后, 由于水合Na+离子在PVDF超滤膜及BSA表面的不断吸附累积, 有效触发了水合作用力, 从而削弱PVDF-BSA及BSA-BSA之间的相互作用力, 减缓膜污染.
2.4 BSA带负电条件下膜污染微观作用力随离子强度的变化当pH为9.0, 即BSA带负电荷时, 离子强度为0、1、10及100 mmol/L条件下, 膜通量衰减率分别为41.36%、55.88%、61.31%、46.23%.相应离子条件下PVDF-BSA之间的平均作用力分别为1.1、1.7、2.3、1.1 mN/m, BSA-BSA之间的的平均作用力分别为0.10、0.11、0.34、0.21 mN/m, 相应的典型作用力曲线如图 4所示.
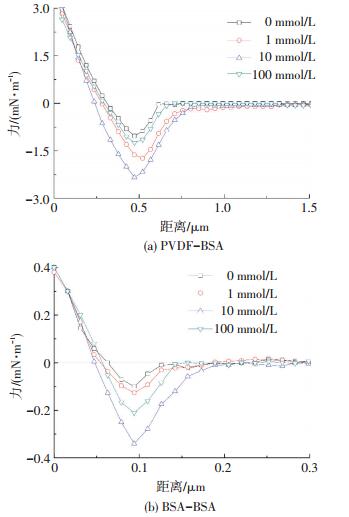
|
图 4 BSA带负电性条件下PVDF-BSA及BSA-BSA之间的典型作用力曲线随离子强度的变化 Figure 4 Representative normalized interaction forces versus characteristics of PVDF-BSA and BSA-BSA at different ionic strengths and negative charge of BSA |
不难发现, 与pH4.7时的作用力及膜通量衰减率变化特征相似, pH为9时, PVDF-BSA与BSA-BSA之间作用力及通量衰减率随离子强度的增大亦呈现先增大后减小的趋势.说明在此条件下亦有效触发了水合作用力.这也是因为, 在pH为9时, BSA及PVDF表面皆带负电荷, 随着离子强度的增大, 二者表面吸附累积大量的水合Na+离子, 进而触发了水合作用力, 减缓膜污染.
此外, 结合图 3发现, 在pH 4.7时, 当离子强度达到10 mmol/L, 膜污染微观作用力明显减小.但是pH为9时, 离子强度达到100 mmol/L时, 才能观察到PVDF-BSA及BSA-BSA间作用力的减小.说明BSA所带负电荷越多, 反而越不易观察到水合作用力.这可能是因为在相同的离子强度变化范围内, 当pH为9时, 膜面及BSA表面所带净电荷量大幅度减小, 相应静电作用力的变化幅度较大, 所以, 需要更强的水合作用力来掩盖静电力的变化量.
3 结论1) 在超滤过程中, 当pH及离子强度满足一定条件, 水合离子大量吸附于蛋白质及超滤膜表面,形成特定水合层, 有效地触发了水合排斥力, 水合排斥力可减弱膜-蛋白质及蛋白质-蛋白质之间的吸引力, 减缓膜污染.
2) BSA带正电性条件下膜污染微观作用力测定结果表明:当pH为3.0时, BSA带正电性, 而PVDF膜带负电性, 膜-BSA之间的作用力随着离子强度的增大而减小, BSA-BSA之间的作用力随着离子强度的增大而增大, 完全遵循DLVO理论, 此时静电作用力是主导因素, 无水合作用力.
3) 当BSA呈电中性或电负性时, PVDF膜表面呈负电性,二者表面均吸附水合阳离子, 当离子强度达到一定值时, 由水合阳离子触发的水合排斥力将掩盖部分膜-BSA及BSA-BSA之间的吸引力, 有效削弱膜-BSA及BSA-BSA之间的作用力, 且在BSA等电点更容易观察到水合作用现象.BSA带电性能及其离子强度是超滤过程中控制水合作用的关键因素.
| [1] |
HASHINO M, HIRAMI K, ISHIGAMI T, et al. Effect of kinds of membrane materials on membrane fouling with BSA[J].
Fuel & Energy Abstracts, 2011, 384(1): 157-165.
|
| [2] |
MENG F, CHAE S R, SHIN H S, et al. Recent advances in membrane bioreactors: configuration development, pollutant elimination, and sludge reduction[J].
Environmental Engineering Science, 2011, 29(3): 139-160.
|
| [3] |
XIAO K, XU Y, LIANG S, et al. Engineering application of membrane bioreactor for wastewatertreatment in China: Current state and future prospect[J].
Front Env Sci Eng, 2014(8): 805-819.
|
| [4] |
HE X, MENG F, LIN A, et al. Monovalent ion-mediated fouling propensity of model proteins during low-pressure membrane filtration[J].
Separation & Purification Technology, 2015, 152: 200-206.
|
| [5] |
KIM H C, DEMPSEY B A. Effects of wastewater effluent organic materials on fouling in ultrafiltration[J].
Water Research, 2008, 42(13): 3379-3384.
DOI: 10.1016/j.watres.2008.04.021 |
| [6] |
BROENS F, MENNE D, POTHOF I, et al. Water hammer reduces fouling during natural water ultrafiltration[J].
Water Research, 2012, 46(4): 1113-1120.
DOI: 10.1016/j.watres.2011.12.011 |
| [7] |
MIAO R, WANG L, MI N, et al. Enhancement and mitigation mechanisms of protein fouling of ultrafiltration membranes under different ionic strengths[J].
Environmental Science & Technology, 2015, 49(11): 6574-6580.
|
| [8] |
WANG Y N, TANG C Y. Protein fouling of nanofiltration, reverse osmosis, and ultrafiltration membranes—The role of hydrodynamic conditions, solution chemistry, and membrane properties[J].
Journal of Membrane Science, 2011, 376(1/2): 275-282.
|
| [9] |
BHATTACHARJEE S, CHEN J Y, ELIMELECH M. DLVO interaction energy between spheroidal particles and a flat surface[J].
Physicochemical and Engineering Aspects, 2000, 165: 143-156.
DOI: 10.1016/S0927-7757(99)00448-3 |
| [10] |
MO H, TAY K G, NG H Y. Fouling of reverse osmosis membrane by protein (BSA): Effects of pH, calcium, magnesium, ionic strength and temperature[J].
Journal of Membrane Science, 2008, 315(s 1/2): 28-35.
|
| [11] |
PARIDA V, NG H Y. Forward osmosis organic fouling: Effects of organic loading, calcium and membrane orientation[J].
Desalination, 2013, 312: 88-98.
DOI: 10.1016/j.desal.2012.04.029 |
| [12] |
ZHANG Y, MA F, LI G. Fouling of ultrafiltration membrane by algal-rich water: Effect of kalium, calcium, and aluminum[J].
Journal of Colloid and Interface Science, 2013, 405: 22-27.
DOI: 10.1016/j.jcis.2013.05.056 |
| [13] |
米娜, 王磊, 苗瑞, 等. 不同离子强度下蛋白质在PVDF膜面吸附行为评价[J].
哈尔滨工业大学学报, 2016, 48(2): 109-113.
MI N, WANG L, MIAO R, et al. Protein adsorption behavior evaluation under different ionic strength on PVDF membrane[J]. Journal of Harbin Institute of Technology, 2016, 48(2): 109-113. DOI: 10.11918/j.issn.0367-6234.2016.02.018 |
| [14] |
TANSEL B, SAGER J, RECTOR T, et al. Significance of hydrated radius and hydration shells on ionic permeability during nanofiltration in dead end and cross flow modes[J].
Separation and Purification Technology, 2006, 51: 40-47.
DOI: 10.1016/j.seppur.2005.12.020 |
| [15] |
HUANG H H, RUCKENSTEIN E. Effect of hydration of ions on double-layer repulsion and the hofmeister series[J].
Journal of Physical Chemistry Letters, 2013, 4: 3725-3727.
DOI: 10.1021/jz401948w |
| [16] |
LEE S, ELIMELECH M. Salt cleaning of organic-fouled reverse osmosis membranes[J].
Water Research, 2007, 41(5): 1134-1142.
DOI: 10.1016/j.watres.2006.11.043 |
| [17] |
MANCIU M, RUCKENSTEIN E. Role of the hydration force in the stability of colloids at high ionic strengths[J].
Langmuir, 2001, 17(22): 7061-7070.
DOI: 10.1021/la010741t |
| [18] |
PARSEGIAN V A, ZEMB T. Hydration forces: Observations, explanations, expectations, questions[J].
Current Opinion in Colloid & Interface Science, 2011, 16(6): 618-624.
|
 2017, Vol. 49
2017, Vol. 49


