2. 燕山大学 车辆与能源学院, 河北 秦皇岛 066004
2. College of Vehicles and Energy, Yanshan University, Qinhuangdao 066004, Hebei, China
燃煤电厂, 特别是燃用高硫煤电厂, 可产生大量SO2[1]. SO2在炉膛及尾部烟道输运过程中会产生一种更难以脱除的污染物SO3[2-5].在炉膛中, 若燃烧区域有富余氧分, 部分SO2向SO3的转化率约为0.5%~1.5 %[6].炉膛外, 当烟气流经SCR装置时, 部分SO2在催化剂的作用下同样可转化为SO3, 转化率约为1%[7-8].此外, 若烟道受热表面覆盖Fe2O3、V2O5、SiO2、Cr2O3等金属氧化物, 烟气中富含的大量SO2依然可以高效、快速地转化为SO3.相比SO2, SO3属于微量污染物, 生成量较低, 然而其造成的危害却不容忽视.在炉膛中, SO3与管壁表面的Fe2O3反应生成结构疏松的硫酸铁, 从而造成管壁的腐蚀[9].烟气中SO3含量的增加会使烟气酸露点相应升高, 增加了空预器及尾部管道被腐蚀的风险[3, 10-12].特别对于装有SCR脱硝设备的机组, 在中高温度[13]窗口条件下, SO3浓度可增加一倍, 不仅会严重影响尾部管道, 还会与过量的氨气生成(NH4)HSO4和(NH4)2SO4, 会堵塞催化剂表面活性位[14-15].此外, 研究表明[12], 当烟囱出口SO3体积分数大于10-5时, 就会产生“蓝羽”现象, 同时这种SO3酸雾也是酸雨的直接来源.
针对SO3排放, 美国有22个州对燃煤电厂烟气中的SO3提出了排放限值, 其中14个州的排放限值质量浓度低于6 mg/m3[16].德国虽未单独规定SO3排放限值, 然而却限制SO2及SO3总的排放质量浓度为50 mg/m3[17].我国上海地区也于2017年推出了硫酸雾排放质量浓度低于5 mg/m3的标准.然而, 由于SO3浓度低、活性大以及高浓度SO2等因素的干扰, 使得烟气中SO3浓度的精确检测一直是难点.虽然见诸于报道的SO3检测技术较多, 但是各有其缺陷, 导致国内目前尚无统一的、广泛认可的检测技术.相对而言, Cheney等[18]提出的人为控制冷凝法(Controlled Condensation Method, 简写CCM)被认为测量电厂低浓度SO3/H2SO4最精确的方法, 该方法也被很多人所推荐使用[19-20].然而, CCM装置复杂, 硫酸蒸汽易损失, 螺旋管分离超细硫酸雾液滴的效率难以保证, 因此限制了CCM技术的进一步发展.此外, 异丙醇法也是一种较为常用的SO3测试方法.然而, 由于SO2在异丙醇中可溶解, 使得该方法有较大误差.该方法的主要干扰物还包括氟化物/逃逸氨等[16].
相比于CCM方法, 盐吸收法是一种更为简单的SO3/H2SO4测量方法, 已被多个学者所验证[21-24], 其原理是:含有硫酸气溶胶的烟气被加热到酸露点温度以上并通过一个装有NaCl盐的吸收管, H2SO4蒸汽被NaCl盐吸收产生硫酸根离子, 随后收集样品通过离子色谱等非在线法进行测量. NaCl盐在吸收H2SO4蒸汽的同时, 会释放出HCl气体.理论上, 通过监测HCl气体可间接获得H2SO4蒸汽浓度, 从而实现在线测量. Hirosh利用此原理研究并证实了NaCl盐吸法在线测量SO3的可能性.然而NaCl与H2SO4蒸汽非单一性质反应, 反应物H2SO4蒸汽与产物HCl的化学计量系数之比并不恒定.在NaCl基础上, Vainio等[25]首次选用CaCl2作为吸收剂进行了初步研究, 结果表明H2SO4蒸汽与CaCl2反应生成的HCl体积分数之比恒为1:2, 且SO2在硫酸蒸汽测量中并不形成干扰, 是一种可行的在线检测方法.同时, 研究也指出当硫酸蒸汽不存在时, SO2会产生一定程度的消耗, 表明SO2在盐吸收管中发生了微弱反应.然而, Vainio并未对其进一步研究.
基于此, 本文对SO2在CaCl2吸收管中所发生的反应及反应所需条件进行了实验探索, 并分析了其可能的反应机制, 为CaCl2盐吸法的进一步应用提供指导.
1 实验装置及方法 1.1 实验系统本文所用实验装置如图 1所示, 主要由石英管反应器、配气系统、增湿系统、分析测量系统等组成.其中, 石英管反应器可耐1 150 ℃高温, 中部设计为磨砂缩口结构, 与同样做成磨砂结构的石英吊篮配合使用, 以达到密封效果.配气系统由气瓶、质量流量计(MFC)、混气罐等组成.进入石英管反应器的气流分为两路, 一路由纯净氩气和水蒸气组成, 气流量为0.75 L/min; 另一路由Ar、SO2和O2组成, 气流量同样为0.75 L/min.增湿系统由微型注射泵(型号TYD01-01)、伴热装置、缓冲罐组成, 通过微型泵精确给水及加热汽化, 实现不同水蒸气浓度的气流供给.测试系统由两级过滤器、烟气分析仪(Testo 340)组成, 用来监测反应器后SO2浓度变化.
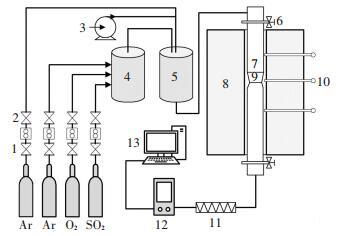
|
1—减压阀; 2—质量流量计; 3—注射泵; 4—混合器; 5—缓冲室; 6—阀门; 7—反应器; 8—管式炉; 9—吊篮; 10—热电偶; 11—过滤器; 12—烟气分析仪; 13—电脑 图 1 实验系统 Figure 1 Schematic profile of experimental system |
实验前, 使用高精度电子天平称取足量CaCl2颗粒并放入真空干燥箱, 设定温度为300 ℃, 使CaCl2颗粒表面水分完全蒸发. 2 h后, 将充分干燥的CaCl2样品放入干燥皿, 冷却至室温后装入密封袋备用.为进行干/湿CaCl2颗粒实验对比, 称取1 g CaCl2颗粒放置于室温条件下, 180 s后立即装入石英管反应器以避免潮湿颗粒黏结。
蒸汽伴热温度设定为165 ℃, 在此条件下, 假定由注射泵供给的微量水分被高温气流完全汽化并全部进入反应器.此外, 假定完全汽化的水蒸气为理想气体, 通过理论折算获得0.5 %及5.0 %体积分数的气流.实验通过控制变量法依次对不同反应物成分及不同反应条件下的SO2浓度变化进行监测, 以此来判定反应是否进行以及反应的强弱.为减少实验过程中的干扰因素, 每组实验称取相同质量的1 g CaCl2颗粒, 每组实验持续30 min并重复3次取平均值.本文所有实验工况及反应条件如表 1所示。
| 表 1 实验工况及条件 Table 1 Experimental conditions |
在实验完成之后, 收集一定反应条件下的固体反应产物进行硫酸根离子分析, 以此验证SO2确被CaCl2所吸收。将反应完成后的固体产物溶于10 mL去离子水中, 将此溶液置于250 mL烧杯中, 加水至150 mL, 加入2滴甲基红指示剂以及2 mol/L的盐酸溶液至红色, 加热10 min。之后, 加入过量氯化钡溶液(100 g/L)直到不再出现沉淀为止。使用恒重的玻璃坩埚过滤沉淀, 并用去离子水反复洗涤沉淀物至没有氯离子为止。将沉淀物在105 ℃干燥2 h, 随后冷却至室温称重。硫酸根质量浓度为
| $ w = ({m_1} - {m_2}) \times 0.4115 \times 1000/V. $ |
式中: w为硫酸根离子质量浓度, mg/L; m1为坩埚加硫酸钡质量, mg; m2为坩埚质量, mg; V为试液体积, mL.
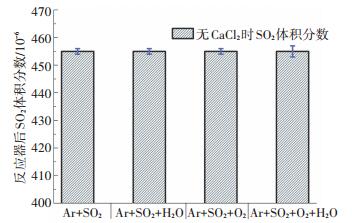
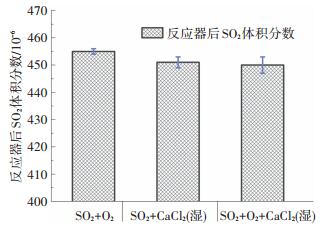
2 结果及讨论 2.1 均相条件对SO2反应的影响为了明确SO2在盐吸收管中能否发生均相反应, 需要在无CaCl2样品条件下进行空样实验.首先在Ar气流中对SO2浓度进行标定, 其次分别选择Ar+SO2+H2O、Ar+SO2+O2以及Ar+SO2+O2+H2O进行实验, 结果如图 2所示.在水蒸气以及O2单独存在条件下, SO2浓度并未减少.即使在水蒸气以及O2混合气氛下, SO2浓度误差较单独气氛有所增加, 然而SO2浓度平均值依然没有降低.因此, 在200 ℃以及典型的烟气气氛下, SO2并不会发生均相反应.
|
图 2 SO2空样浓度标定 Figure 2 SO2 concentration under homogeneous conditions |
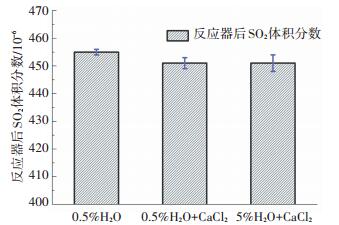
为了探究SO2发生非均相反应所需条件, 实验在O2和水蒸气单独存在条件下进行.首先, 在无氧条件下, 将SO2及不同水蒸气浓度的混合气通入装有CaCl2样品的反应器, 结果如图 3所示.在空样体积分数为455×10-6对比下, 体积分数0.5% H2O条件下的SO2浓度略为降低.在体积分数5.0% H2O条件下, SO2浓度误差区间较体积分数0.5% H2O条件下有所增加, 然而其平均浓度并未降低.综合来看, 两种水蒸气浓度条件下的SO2体积分数都只轻微减小3×10-6, 这可以认为是CaCl2物理吸附的结果.因此, 在200 ℃及该反应气氛下, SO2与CaCl2并未发生化学反应.
|
图 3 无氧条件下SO2体积分数 Figure 3 SO2 volume concentration without oxygen |
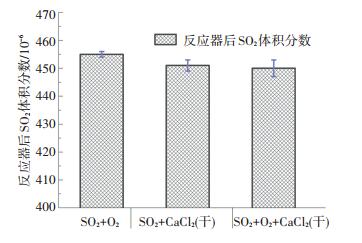
同样, 在无H2O条件下, 将SO2及O2混合气通入放有干燥CaCl2样品的反应器, 出口SO2浓度如图 4所示.相比无氧及均相条件, 有氧条件下的SO2浓度误差带有所增加, 然而平均浓度并未明显减少.因此, 在200 ℃及无H2O非均相条件下, 损失的微量SO2以物理吸附为主, 并未发生明显的化学反应.
|
图 4 无水蒸气条件下SO2体积分数 Figure 4 SO2 volume concentration without water vapor |
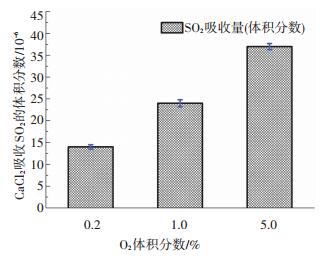
在O2/H2O/SO2/Ar气氛下, 给定H2O体积分数为5.0 %, O2浓度以及SO2浓度对CaCl2吸收SO2的影响分别如图 5及图 6所示.
|
图 5 O2浓度变化对CaCl2吸收SO2的影响 Figure 5 Effect of oxygen volume concentration on the reaction between SO2 and CaCl2 |

|
图 6 SO2体积分数变化对CaCl2吸收SO2的影响 Figure 6 Effect of reactant (SO2) on the reaction between SO2 and CaCl2 |
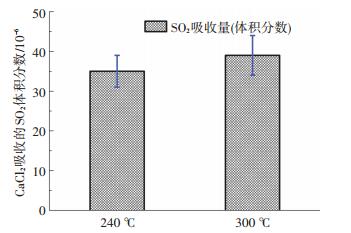
随着O2浓度及SO2浓度的增加, CaCl2样品对SO2的吸收率明显增加.这是由于随着反应物浓度的增加, 促进了SO2向H2SO4蒸汽的转化, 使得反应速率相对增加.然而, SO2整体吸收率仍然较低, 即使在体积分数5.0% O2条件下, SO2吸收率约为8%.反应温度对SO2与CaCl2非均相反应的影响如图 7所示.随着反应温度的增加, SO2的吸收率有所增加, 这与绝大多数反应的反应速率随温度升高而增大相似.温度升高, 气体分子的运动速率增大, 不仅使气体分子在单位时间内碰撞频率增加, 更使气体分子的能量增加, 活化分子比例增加, 提高了反应的效率。
|
图 7 反应器温度对CaCl2吸收SO2的影响 Figure 7 Effect of temperature on the reaction between SO2 and CaCl2 |
为验证减少的SO2被CaCl2所吸收, 实验收集了体积分数5.0% O2条件下的固体反应产物, 并对其中的硫酸根离子量进行了分析, 结果如表 2所示.
| 表 2 反应前后硫酸根离子质量浓度 Table 2 Mass concentration of sulfate anion before and after reaction |
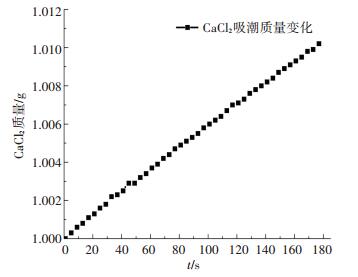
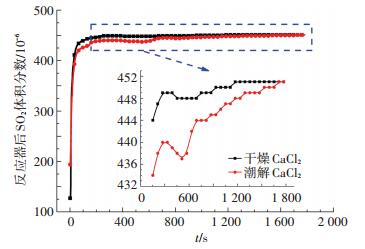
为验证SO2发生非均相反应的条件, 将1 g CaCl2干燥样品潮解之后放入反应器并通入SO2及O2混合气, CaCl2样品潮解曲线如图 8所示, 反应最终结果如图 9所示.由图 9可知, 反应后SO2最终浓度相较无H2O气氛及干燥CaCl2条件并未减小.然而, 相比干燥CaCl2条件, SO2与潮湿CaCl2样品反应过程却有明显不同, 如图 10所示.潮湿CaCl2样品条件下, SO2浓度在反应过程中明显偏低且最终稳定浓度相比干燥条件明显滞后.干燥CaCl2条件下, SO2在物理吸附过程中较快达到平衡.潮解之后的CaCl2样品在反应器200 ℃条件下, 水分快速蒸发, 使得反应器中短暂存在SO2/O2/H2O混合气氛.在此混合气氛下, SO2与CaCl2样品发生了极慢化学反应, 使SO2浓度明显减小.然而, 水蒸气在反应过程及气流携带作用下不断消耗, 最终成为SO2/O2混合气氛, SO2浓度也随之稳定.
|
图 8 室温条件下CaCl2吸潮曲线 Figure 8 Moisture absorption curve of CaCl2 at room temperature |
|
图 9 潮解氯化钙条件下SO2体积分数 Figure 9 SO2 volume concentration with wetted CaCl2 |
|
图 10 反应过程中SO2体积分数变化对比 Figure 10 Comparison of SO2 volume concentration in entire reaction process |
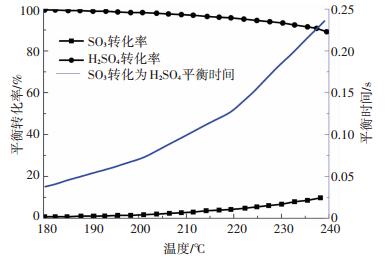
由前述可知, 只有当O2和H2O同时存在时, SO2与CaCl2才能发生明显的化学反应.然而, 此反应速率较低, 且有研究[14]表明, 该反应在硫酸蒸汽存在条件下并不能进行, 也即硫酸蒸汽的存在抑制了该反应.基于此, 本文推出了SO2与CaCl2可能的反应发生过程.首先, CaCl2基质的存在提供了气相反应发生的场所, 使得被吸附的少量SO2与O2首先发生极慢反应, 生成极少量的SO3, 如方程(1)所示.由于此反应速率极低, SO2消耗量相比物理吸附并不明显, 因此在图 4中并未出现SO2浓度明显减少的情况.同时, 研究表明[26-29], SO3在水蒸气存在条件下能够快速转换成H2SO4蒸汽且随温度呈现明显的负相关, 反应过程如方程(2)及(3)所示.通过理论计算[22]的SO3反应结果如图 11所示.
|
图 11 SO3反应平衡转化率及平衡时间 Figure 11 Equilibrium conversion rate and equilibrium time for SO3 reaction |
| $ {\text{S}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right){\text{ + }}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)\xrightarrow{{{\text{CaC}}{{\text{l}}_{\text{2}}}}}{\text{S}}{{\text{O}}_{\text{3}}}\left( {\text{g}} \right){\text{, }} $ | (1) |
| $ {\text{S}}{{\text{O}}_{\text{3}}}\left( {\text{g}} \right){\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right) \rightleftharpoons {\text{S}}{{\text{O}}_{\text{3}}} \cdot {{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right){\text{, }} $ | (2) |
| $ {\text{S}}{{\text{O}}_{\text{3}}} \cdot {{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right){\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}}\left( {\text{g}} \right) \rightleftharpoons {{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}\left( {\text{g}} \right){\text{.}} $ | (3) |
在体积分数5.0% H2O及200 ℃条件下, SO3反应生成H2SO4蒸汽的转化率高达99%以上, 且达到反应平衡所需的时间极短.由此可知, 水蒸气的存在使得反应器中极微量的SO3快速消耗, 推动了SO2向SO3转化的同时也促进了SO3向H2SO4蒸汽的转化.最终, SO2在水蒸气及氧化性气氛下能与CaCl2发生慢化学反应, 如方程(1)~(4)所示:
| $ {{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}\left( {\text{g}} \right){\text{ + CaC}}{{\text{l}}_{\text{2}}}\left( {\text{s}} \right){\text{ = CaS}}{{\text{O}}_{\text{4}}}\left( {\text{s}} \right){\text{ + 2HCl}}\left( {\text{g}} \right){\text{.}} $ | (4) |
SO2的整体反应方程如式(5)所示.
| $ \begin{gathered} {\text{2S}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right){\text{ + 2}}{{\text{H}}_{\text{2}}}{\text{O + 2CaC}}{{\text{l}}_{\text{2}}}\left( {\text{s}} \right){\text{ + }}{{\text{O}}_{\text{2}}}{\text{ = }} \hfill \\ \;\;\;\;\;\;\;\;\;\;{\text{2CaS}}{{\text{O}}_{\text{4}}}\left( {\text{s}} \right){\text{ + 4HCl}}\left( {\text{g}} \right){\text{.}} \hfill \\ \end{gathered} $ | (5) |
由于此反应是气-固相非催化反应, 气速高, 通过气膜的外扩散阻力很小, 又因为较低的转化率使得固体产物层很薄, 所以此反应符合化学反应控制下的缩芯模型.当化学反应为速率控制步骤时, 反应速率满足如下方程:
| $ \begin{gathered} 4{{\pi }}R_{\text{c}}^2k{c_{{\text{S}}{{\text{O}}_{\text{2}}}}} = - \frac{{4{{\pi }}{\rho _{{\text{CaC}}{{\text{l}}_{\text{2}}}}}}}{{b{m_{{\text{CaC}}{{\text{l}}_{\text{2}}}}}}}R_{\text{c}}^2\frac{{{\text{d}}{R_{\text{c}}}}}{{{\text{d}}t}} - \hfill \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\frac{{{\rho _{{\text{CaC}}{{\text{l}}_{\text{2}}}}}}}{{{M_{{\text{CaC}}{{\text{l}}_{\text{2}}}}}}}\smallint _{{R_{\text{s}}}}^{{R_{\text{c}}}}{\text{d}}{R_{\text{c}}} = bk{c_{{\text{S}}{{\text{O}}_{\text{2}}}}}\smallint _0^t{\text{d}}t.. \hfill \\ \end{gathered} $ |
式中:Rc为未反应芯半径, k为反应速率常数, cSO2为SO2气相主体浓度, ρCaCl2为CaCl2样品密度, b为CaCl2反应物化学计量数, mCaCl2为CaCl2相对分子质量.积分后可得反应时间t表达式:
| $ t = \frac{{{\rho _{{\text{CaC}}{{\text{l}}_{\text{2}}}}}{R_{\text{s}}}}}{{bk{m_{{\text{CaC}}{{\text{l}}_{\text{2}}}}}{c_{{\text{S}}{{\text{O}}_{\text{2}}}}}}}[1 - {(1 - {x_{\text{B}}})^{1/3}}]. $ |
根据实验数值并代入相关常数量可得CaCl2反应率在SO2、H2O及O2气氛下与反应时间的关系式:
| $ t = 8.93 \times {10^3} \times [1 - {(1 - {x_{\text{B}}})^{1/3}}]. $ | (6) |
式中: t(min)为反应时间, Rs为原始固体反应物半径, 本文取值2 mm, xB为反应物转换率.由式(6)可知, 较小的转化率对应较长的反应时间, 反应极微弱.而当硫酸蒸汽存在时, SO2与CaCl2间的非均相反应被进一步削弱, 使得SO2对氯化钙盐吸法测量SO3的影响可忽略不计, 一定程度上证实了氯化钙盐吸法测量SO3的可行性.
3 结论1) 在200 ℃下, SO2在O2/H2O气氛中不能发生均相反应, 因此排除了SO2均相反应对氯化钙盐吸法测量的干扰.
2) 在O2或H2O气氛单独存在条件下, SO2并不能与CaCl2发生非均相反应.而只有当O2、H2O同时存在时, SO2与CaCl2发生极慢化学反应, 且反应随着浓度增加及温度身高, 反应速率缓慢提高.
3) CaCl2表面化学反应为其速率控制步骤, 整体反应符合气-固相非催化缩芯模型.而H2SO4蒸汽存在下的抑制机理使得该反应对氯化钙盐吸法测量SO3并不能形成严重干扰, 一定程度上证明了此种方法测量SO3的可行性.
| [1] |
李伟, 李诗媛, 徐明新, 等. 循环流化床富氧燃烧SO2排放和石灰石脱硫特性研究[J]. 中国电机工程学报, 2014, 34(27): 3932. LI Wei, LI Shiyuan, XU Mingxin, et al. Study on SO2 emission and limestone desulfurization characteristics for oxy-fuel circulating fluidized bed combustion[J]. Proceedings of the CSEE, 2014, 34(27): 3932. DOI:10.13334/j.0258-8013.pcsee.2014.23.013 |
| [2] |
OFFEN G.Modeling of SO3 formation process in coal-fired boilers: EPRI Report[R].[S.l.]: Electric Power Research Institute, 2007
|
| [3] |
常景彩.柔性集尘极应用于燃煤脱硫烟气深度净化的试验研究[D].济南: 山东大学, 2011 CHANG Jingcai.Experimental study on flexible collection electrode applied in advanced purification for coal-fired flue gas following WFGD[D].Jinan: Shandong University, 2011 http://cdmd.cnki.com.cn/article/cdmd-10422-1011170331.htm |
| [4] |
楼清刚. 燃煤过程中SO3生成的试验研究[J]. 能源与环境, 2008(6): 46. LOU Qinggang. Study on the formation mechanism of SO3 during coal burning[J]. Energy and Environmental, 2008(6): 46. DOI:10.16189/j.cnki.nygc.2008.06.002 |
| [5] |
王宏亮, 薛建明, 许月阳, 等. 燃煤电站锅炉烟气中SO3的形成及控制[J]. 电力科技及环保, 2014, 30(5): 17. WANG Hongliang, XUE Jianming, XU Yueyang, et al. Formation and control of SO3 from coal-fired power plants[J]. Electric Power Technology and Environmental Protection, 2014, 30(5): 17. |
| [6] |
郝吉明. 燃煤二氧化硫污染控制技术手册[M]. 北京: 化学工业出版社, 2002: 45. HAO Jiming. Technical manual for sulfur dioxide pollution control in coal combustion[M]. Beijing: Chemical Industry Press, 2002: 45. |
| [7] |
陈晓露, 赵钦新, 鲍颖群, 等. SO3脱除技术实验研究[J]. 动力工程学报, 2014, 34(12): 966. CHEN Xiaolu, ZHAO Qinxin, BAO Yingqun, et al. Experimental research on removal technology of SO3[J]. Journal of Chinese Society of Power Engineering, 2014, 34(12): 966. |
| [8] |
MITSUI Y, IMADA N, KIKKAWA H, et al. Study of Hg and SO3 behavior in flue gas of oxy-fuel combustion system[J]. International Journal of Greenhouse Gas Control, 2011, 5(S1): S143. DOI:10.1016/j.ijggc.2011.05.017 |
| [9] |
樊泉贵, 闫维平, 闫顺林, 等. 锅炉原理[M]. 北京: 中国电力出版社, 2008: 182. FAN Quangui, YAN Weiping, YAN Shunlin, et al. Boiler principle[M]. Beijing: China Electric Power Press, 2008: 182. |
| [10] |
OTSUKA N. Effects of fuel impurities on the fireside corrosion of boiler tubes in advanced power generating systems-a thermodynamic calculation of deposit chemistry[J]. Corrosion Science, 2002, 44(2): 265. DOI:10.1016/S0010-938X(01)00060-9 |
| [11] |
肖雨亭, 贾曼, 徐莉, 等. 烟气中三氧化硫及硫酸雾液滴的分析方法[J]. 环境科技, 2012, 25(5): 43. XIAO Yuting, JIA Man, XU Li, et al. The analytic method of sulfur and sulfuric acid mist in flue gas[J]. Environmental Science and Technology, 2012, 25(5): 43. |
| [12] |
闫君.湿式静电除雾器脱除烟气中酸雾的试验研究[D].济南: 山东大学, 2010 YAN Jun.Experimental study on removal of acid mist from flue gas using wesp[D].Jinan: Shandong University, 2010 http://cdmd.cnki.com.cn/article/cdmd-10422-2010099722.htm |
| [13] |
梁红亮, 郭宾彬. SCR催化剂的研究应用状况和发展方向[J]. 科技情报开发与经济, 2008, 18(14): 120. LIANG Hongliang, GUO Binbin. The present situation of the research on and application of SCR catalysts and development requirements[J]. Sci-Tech Information Development & Economy, 2008, 18(14): 120. DOI:10.3969/j.issn.1005-6033.2008.14.070 |
| [14] |
沈伯雄, 施建伟, 杨婷婷, 等. 选择性催化还原脱氮催化剂的再生及其应用评述[J]. 化工进展, 2008, 27(1): 64. SHEN Boxiong, SHI Jianwei, YANG Tinging, et al. Regeneration technologies of SCR catalysts and their applications[J]. Chemical Industry and Engineering Progress, 2008, 27(1): 64. DOI:10.16085/j.issn.1000-6613.2008.01.022 |
| [15] |
FLEIG D, NORMANN F, ANDERSSON K, et al. The fate of sulphur during oxy-fuel combustion of lignite[J]. Energy Procedia, 2009, 1(1): 383. DOI:10.1016/j.egypro.2009.01.052 |
| [16] |
张悠.烟气中SO3测试技术及其应用研究[D].杭州: 浙江大学, 2013 ZHANG You.Research and application of SO3measurements in flue gas[D].Hangzhou: Zhejiang University, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10335-1013186809.htm |
| [17] |
赵瑞, 刘毅, 李延兵, 等. 浅谈燃煤电站SO3检测方法及脱除策略[J]. 神华科技, 2015, 13(5): 62. ZHAO Rui, LIU Yi, LI Yanbing, et al. Review on the SO3 detection method and removal strategy in coal-fired power plants[J]. Shenhua Science and Technology, 2015, 13(5): 62. DOI:10.3969/j.issn.1674-8492.2015.05.021 |
| [18] |
CHENEY J L, HOMOLYA J B. Sampling parameters for sulfate measurement and characterization[J]. Environmental Science & Technology, 1979, 13(5): 584. |
| [19] |
JAWOROWSKI R, MACK S. Evaluation of methods for measurement of SO3/H2SO4 in flue gas[J]. Journal of the Air Pollution Control Association, 1979, 29(1): 43. DOI:10.1080/00022470.1979.10470750 |
| [20] |
KOEBEL M, ELSENER M. Schwefeltrioxid bestimmung in abgasen nach der isopropanol methode: eine kritische betrachtung[J]. Gefahrstoffe Reinhaltung der Luff, 1997, 57(5): 193. |
| [21] |
COOPER D, FERM M.Jämfoörelse av mätmetoder för bestämningav SO3 koncentrationer i rökgaser[R].Goöteborg: Institutet för Vattenoch Luftvaardsforskning (IVL), 1994
|
| [22] |
FLEIG D, VAINIO E, ANDERSSON K, et al. Evaluation of SO3 measurement techniques in air and oxy-fuel combustion[J]. Energy & Fuels, 2012, 26(9): 5537. DOI:10.1021/ef301127x |
| [23] |
COOPER D.Optimization of a NaCl adsorbent tube method for SO3 measurements in combustion flue gases[R].Göteborg: Institutet för Vattenoch Luftvaardsforskning (IVL), 1995
|
| [24] |
COOPER D, ANDERSSON C.Bestamning av SO3 i Rökgaser med NaCl-metoden-en Jämförelse av olika metoder[R].Göteborg: Institutet för Vattenoch Luftvaardsforskning (IVL), 1997
|
| [25] |
VAINIO E, FLEIG D, BRINK A, et al. Experimental evaluation and field application of a salt method for SO3 measurement in flue gases[J]. Energy & Fuels, 2013, 27(5): 2767. DOI:10.1021/ef400271t |
| [26] |
LOVEJOY E, HANSON D, HUEY L G. Kinetics and products of the gas-phase reaction of SO3 with water[J]. The Journal of Physical Chemistry, 1996, 100(51): 19911. DOI:10.1021/jp962414d |
| [27] |
JAYNE J, POSCHL U, CHEN Y, et al. Pressure and temperature dependence of the gas-phase reaction of SO3 with H2O and the heterogeneous reaction of SO3 with H2O/H2SO4 surfaces[J]. The Journal of Physical Chemistry A, 1997, 101(51): 10000. DOI:10.1021/jp972549z |
| [28] |
MOROKUMA K, MUGURUMA C. Ab initio molecular orbital study of the mechanism of the gas phase reaction SO3+ H2O: Importance of the second water molecule[J]. Journal of the American Chemical Society, 1994, 116(22): 10316. DOI:10.1021/ja00101a068 |
| [29] |
KOLB C, JAYNE J, WORSNOP D. Gas phase reaction of sulfur trioxide with water vapor[J]. Journal of the American Chemical Society, 1994, 116(22): 10314. DOI:10.1021/ja00101a067 |
 2018, Vol. 50
2018, Vol. 50


