2. 哈尔滨工业大学 环境学院, 哈尔滨 150090
2. School of Environment, Harbin Institute of Technology, Harbin 150090, China
微生物燃料电池(MFC)能够在微生物的催化作用下将化学能转化为电能,同时实现产电与污染物的处理,已成为环境工程领域的一项重要技术[1-2].但由于输出功率低下,MFC在污染物处理的应用中受到一定限制.有研究将MFC与其他工艺结合,如MBR-MFC[3]、CW-MFC[4]和MFC-SBR[5]等,拓宽了MFC的应用范围.电芬顿(EF)技术利用·OH的无选择性强氧化能力,在处理难降解污染物中表现优秀[6],也因其可以原位产生H2O2,解决了传统Fenton法中H2O2的运输和储存难题,降低了药剂成本[7].然而,EF技术需要外部电能输入,此部分成本的投入也在一定程度上限制其工业化应用.将MFC与EF技术耦合构成生物电芬顿系统(MFC-EF),利用MFC原位产生的电能驱动EF反应降解有机污染物,在实现电能原位利用的同时,保证EF的优势,进一步降低污染物处理能耗,具有良好的发展前景[8-9].
目前对MFC-EF的研究已经初见成效.Fu等[10-12]将MFC与EF结合,通过外加铁源作为EF催化剂,实现了对苋菜红、对硝基苯酚等物质的降解.Zhuang等[13-15]则是在MFC-EF的阴极上负载了不同类型的铁氧化物,在对染料、TPTC等物质的降解中也取得良好效果.通过外加铁离子催化Fenton反应的常规均相EF技术,严格限制了酸性pH范围,还会产生大量的金属沉淀,增加了后续处理的难度.引入其他具有类芬顿(Fenton-like)催化性能的金属与铁共同作用,组建非均相催化体系,可以解决上述问题[16].
锰作为一种Fenton-like催化剂能够促进H2O2生成·OH[17],有研究[18]制备了含有铁锰双金属的催化剂用于Fenton-like系统中,污染物降解效果良好,但目前将铁锰双金属催化剂直接做成阴极材料,并应用于MFC-EF系统的研究很少.因此,本研究聚焦MFC微电的原位利用,结合EF的优势,构建MFC-EF耦合系统,并制备非均相催化电极材料——铁锰复合阴极,以同类研究中常用的、具有代表性的染料罗丹明B(RhB)为目标污染物,与碳纤维(CF)无负载电极以及较为经典的Fe & Fe2O3/CF复合电极[19]对比,探究MFC-EF耦合系统的产电性能和污染物降解效果.本研究旨在实现资源的再生及利用,提高MFC-EF耦合系统的性能及应用范围,并为实际废水的处理提供新的思路.
1 实验 1.1 反应器的构建及运行MFC-EF耦合系统采用双室反应器构型(图 1),反应器壁均采用有机玻璃板制成,两反应室间由PEM膜分隔.反应器的阳极室为密闭式圆柱体型,规格为ϕ85 mm×100 mm,容积550 mL;阴极室为长方体型,规格为60 mm×60 mm×100 mm,容积360 mL.阳极室中设Ag/AgCl参比电极(+0.195 V vs. SHE),阳极室底物为哈尔滨文昌污水处理厂的剩余污泥.阳极材料是由钛丝和碳纤维丝(T700,日本东丽)拧制而成的碳纤维刷,规格为ϕ90 mm×100 mm,阳极和阴极之间通过导线连接外电阻(启动阶段为1 000 Ω).系统运行时保证阳极处于厌氧环境,定期补充更换阳极污泥,以维持反应器的良性运行.启动阶段阴极室电解液为K3[Fe(CN)6](65.8 g/L)与KH2PO4(27.2 g/L)的混合液,每48 h更换一次;启动成功后正式实验时将阴极液换成RhB(30 mg/L)与Na2SO4(0.10 mol/L)的混合液,以上溶液均由蒸馏水配制而成.
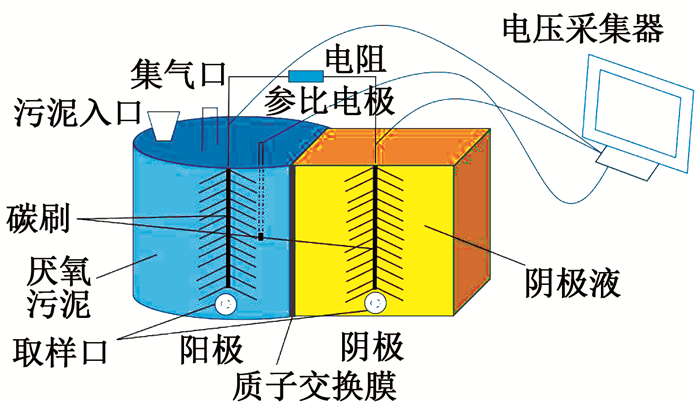
|
图 1 MFC-EF耦合系统反应器构型 Fig. 1 Configuration diagram of the reactor of MFC-EF coupling system |
阴极材料制备时均采用与阳极相同的CF作为基底材料,CF使用前需进行预处理:先用无水乙醇浸泡超声作用1 h,随后分别用1.0 mol/L HCl和1.0 mol/L NaOH浸泡处理4 h,用去离子水冲洗数次,置于80 ℃干燥箱中烘干.预处理后的CF可直接作为CF无负载电极.
Fe & Fe2O3/CF复合电极的制备方法:将2.7 g FeCl3·6H2O和3.6 g NaBH4分别溶解在200和80 mL的去离子水中,将预处理后的CF置于FeCl3溶液中超声20 min,然后将NaBH4缓慢加入其中,之后用去离子水清洗,在N2中干燥.
FeMnOx/CF复合电极的制备方法:将高锰酸钾(KMnO4,3.0 g)、硫酸亚铁(FeSO4·7H2O,15.6 g)分别溶于250 mL去离子水中.将预处理后的CF浸没于KMnO4溶液中,在剧烈的磁力搅拌下,向KMnO4溶液中缓慢加入FeSO4溶液,同时加入5.0 mol/L NaOH溶液,使溶液的pH保持在7和8之间.加入后,将形成的悬浮液连续搅拌1 h,室温下老化12 h,然后用去离子水将CF进行反复洗涤,在105 ℃下干燥4 h.
采用扫描电子显微镜(SEM,SIGMA300,ZEISS)对电极材料的表面形貌进行分析,用XPS(PHI 5700 ESCA System,美国物理电子公司)确定复合阴极材料中的元素及元素价态.
1.3 电化学性能评价 1.3.1 工作电压MFC-EF耦合系统的工作电压通过多通道电压采集器PISO-813的采集卡(12 bit A/D conversion chips, US)实时测量并记录.
1.3.2 极化曲线和功率密度曲线在MFC-EF耦合系统稳定运行状态下,先将系统开路运行12 h,得到开路电压;然后将反应电路外电阻从9 kΩ逐级减少到10 Ω,记录各级外电阻下稳定的系统总电压,计算电流密度和功率密度,绘制极化曲线和功率密度曲线.
1.4 测试分析方法 1.4.1 H2O2浓度H2O2浓度采用I3-分光光度法进行测定,具体操作方法为:取水样2 mL,分别加入1 mL碘试剂(0.40 mol/L KI,0.06 mol/L NaOH,10-4 mol/L(NH4)2MoO4)和1 mL(0.10 mol/L)邻苯二甲酸氢钾,静置显色,采用紫外分光光度计测352 nm处的吸光度.
1.4.2 电流效率(EC)H2O2的电流效率是电极反应产生H2O2所消耗的电量与反应系统的总电量的比值,即
| $ {E_{\rm{C}}} = \frac{{nFcV}}{{\int_0^t I {\rm{d}}t}} \times 100\% . $ | (1) |
式中:n为H2O2氧还原转移的电子数,F为法拉第常数(96 485 C/mol),c为反应生成的H2O2浓度(mol/L),V为溶液的体积(L),I为电流(A),t为时间(s).
1.4.3 RhB去除率由紫外分光光度计测定554 nm下的吸光度,RhB去除率R计算公式为
| $ R = \frac{{{A_1} - {A_2}}}{{{A_1}}} \times 100\% . $ | (2) |
式中:A1为RhB的初始吸光度,A2为处理后RhB的吸光度.
1.4.4 TOC采用TOC测定仪(TOC-VCPN,日本Shimadzu有限公司)测定阴极液TOC,并计算去除率.
2 结果与讨论 2.1 电极材料表征 2.1.1 电极材料表面形貌分析通过SEM分析电极材料的表面形貌,结果见图 2.CF无负载电极是普通的碳纤维,根据相关文献[20]及经验,易知其表面整体光滑,而Fe & Fe2O3/CF复合电极(图 2(a)、(b))的碳纤维上可以明显看到负载物,粗糙度增加.大部分负载呈现鳞片状结构,但分布不均匀,有团聚现象出现.负载物的团聚不利于与污染物进行充分接触,会影响负载电极的处理效率.FeMnOx/CF复合电极(图 2(c)、(d))的碳纤维上同样拥有丰富的负载,而且负载量更大,包覆性更好,团聚现象消失;除了鳞片状结构的负载,还出现了絮状负载物,有利于增加接触面积和传质效率,提高电极的产电和污染物处理效率.

|
图 2 不同电极SEM图 Fig. 2 SEM diagrams of different electrodes |
为确定复合阴极材料中的元素及其价态,进行XPS测试和分析,结果如图 3,4所示.除了C、O元素,Fe & Fe2O3/CF和FeMnOx/CF复合电极表面还分别检测出Fe、Fe和Mn元素(图 3),证明了相关元素的成功负载.
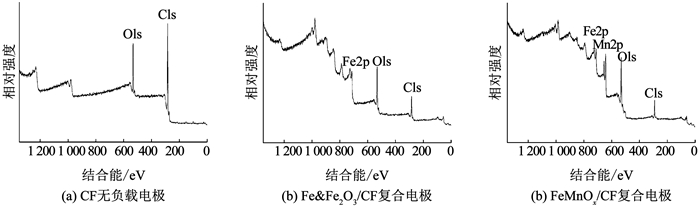
|
图 3 不同电极材料的XPS全谱图 Fig. 3 XPS full spectra of different electrode materials |
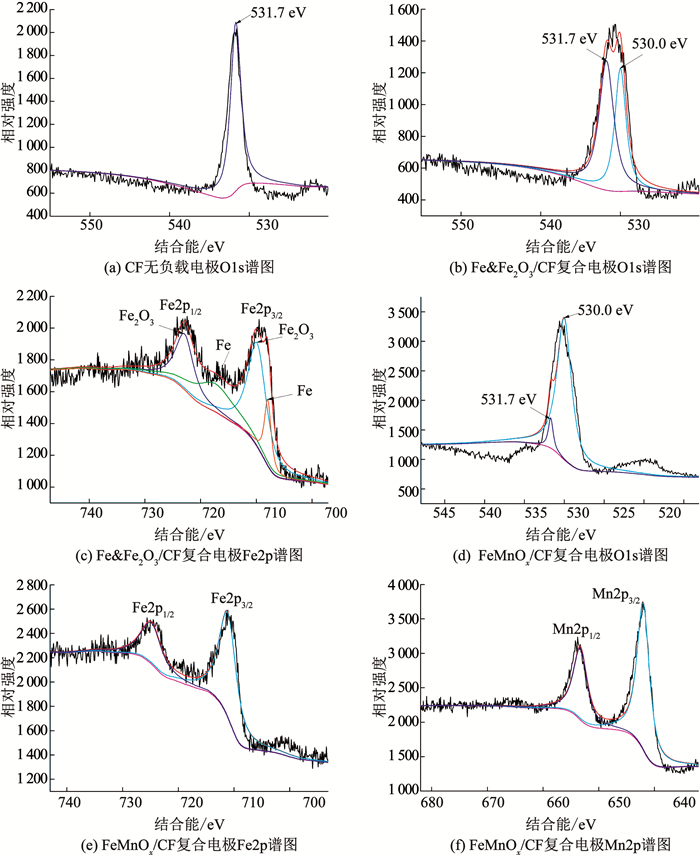
|
图 4 不同电极材料元素的高分辨率谱图 Fig. 4 High resolution spectra of elements in different electrode materials |
CF无负载电极在结合能为531.7 eV处出现O1s特征峰(图 4(a)),此峰可能是由预处理过程吸附在碳纤维表面的·OH、H2O和碳酸盐类物质形成的[21],而Fe & Fe2O3/CF复合电极的O1s谱图中,还增加了结合能为530.0 eV的峰,此峰则是金属氧化物中O1s的特征峰[22];Fe & Fe2O3/CF复合电极Fe2p谱图(图 4(c))中峰的位置出现在709.86 eV、722.88 eV、707.94 eV和717.33 eV,分别对应于文献[22]报道的Fe2O3的Fe2p3/2、Fe2p1/2和Fe0的Fe2p3/2、Fe2p1/2轨道峰.由此说明Fe & Fe2O3/CF复合电极上成功负载了Fe和Fe2O3.
类似地,FeMnOx/CF复合电极中的O也主要来自金属氧化物,Fe2p3/2和Fe2p1/2的轨道峰位置说明FeMnOx/CF复合电极中Fe为3价;Mn2p3/2和Mn 2p1/2轨道峰分别在642.08 eV和653.68 eV,与文献[23]报道的4价Mn相符,说明FeMnOx/CF复合电极中Mn为4价.综上,FeMnOx/CF复合电极上成功负载了Fe(Ⅲ)和Mn(Ⅳ)的二元金属氧化物.
2.2 不同阴极材料所在MFC-EF耦合系统的产电效能分析参考相关文献[24-26],设置阴极染料RhB的初始质量浓度为30 mg/L,支持电解质溶液Na2SO4浓度为0.1 mol/L,初始pH为3,曝气速率为200 mL/min,在上述阴极环境下,测试了FeMnOx/CF复合电极、Fe & Fe2O3/CF复合电极及CF无负载电极在MFC-EF耦合系统中的电化学性能.
2.2.1 工作电压图 5为外电阻为1 000 Ω时不同电极的工作电压情况.3种电极在MFC-EF耦合系统的工作电压存在显著差异,FeMnOx/CF复合电极所在耦合系统的工作电压最高,平均值达0.956 V,比Fe & Fe2O3/CF复合电极(0.559 V)提高了71.14%,比CF无负载电极(0.401 V)提高了138.48%.说明FeMnOx/CF复合电极对MFC-EF耦合系统的工作电压有提升效果,铁、锰双金属的加入比单一的铁负载对耦合系统工作电压的提升作用更加显著.

|
图 5 不同电极所在MFC-EF耦合系统的工作电压 Fig. 5 Working voltages of MFC-EF coupling system with different electrodes |
根据极化曲线和功率密度曲线量化MFC-EF耦合系统的产电效能,结果如图 6所示.经计算得到的FeMnOx/CF复合电极下MFC-EF耦合系统最大功率密度为5.47 W/m3,Fe & Fe2O3/CF复合电极和CF无负载电极下MFC-EF耦合系统最大功率密度分别为2.63和0.52 W/m3.可见,FeMnOx/CF复合电极下MFC-EF耦合系统的最大功率密度有了显著提高.由Rint=-ΔE/ΔI计算得到FeMnOx/CF复合电极、Fe & Fe2O3/CF复合电极和CF无负载电极所在耦合系统的内阻分别为109.00, 115.06和262.80 Ω.

|
图 6 不同电极所在MFC-EF耦合系统的极化曲线和功率密度曲线 Fig. 6 Polarization curve and power density curve of MFC-EF coupling system with different electrodes |
FeMnOx/CF复合电极与Fe & Fe2O3/CF复合电极、CF无负载电极相比,内阻降低,这是由于铁、锰元素对氧还原反应均有催化作用,铁和锰的负载提供了更多的氧还原催化活性中心,提高了氧还原反应活性;而且铁和锰的共同作用比单一的铁对氧还原反应的催化作用更强,可以更有效地降低阴极反应阻力[27].锰元素在催化过程中通过不同价态之间的转换,加速电子的传递速率,降低了氧还原反应的超电势,从而提高了电池的输出功率[28],改善了耦合系统的产电效能,有利于为阴极的电芬顿反应提供更多的电能,实现电能的原位利用及污染物的降解.
2.3 不同阴极材料所在MFC-EF耦合系统对RhB的降解效果分析在与2.2相同的阴极环境下,将外电阻设为100 Ω(接近电池内阻),运行不同阴极材料下的MFC-EF耦合系统,间隔一定时间取样,测定不同阴极下H2O2的产生量及电流效率、RhB去除率和TOC等指标,评价不同阴极对污染物的降解能力.
2.3.1 H2O2的产生量及电流效率不同电极下MFC-EF耦合系统H2O2的产量及电流效率如图 7所示.FeMnOx/CF复合电极下耦合系统的H2O2产率具有明显优势,0.5 h产生的H2O2质量浓度即可达3.69 mg/L,比另外两电极运行5 h产生的H2O2质量浓度还高,且在5 h时达15.82 mg/L.由此说明,MFC-EF耦合系统实现了H2O2的原位产生,并且FeMnOx/CF复合电极极大提高了MFC-EF耦合系统的H2O2产生量.

|
图 7 不同电极所在MFC-EF耦合系统的H2O2产量及电流效率 Fig. 7 Production and current efficiency of hydrogen dioxide in MFC-EF coupling system with different electrodes |
根据式(1)可计算得到不同电极产H2O2的电流效率(图 7(b)).3种电极下产H2O2的电流利用效率均在系统运行最初时最高,并随着反应进行会有所降低,这与H2O2的伴生反应有关[29].FeMnOx/CF复合电极的H2O2电流效率在三者中最高,反应5 h时为40.44%,比同时刻的Fe & Fe2O3/CF复合电极(11.79%)提高了242.94%,进一步证明了金属锰的加入促进了O2的二电子转移过程[30],提高了产H2O2的电子利用率,从而提高了H2O2的产生效率;同时也说明FeMnOx/CF复合电极使MFC-EF耦合系统中的电能得到了更有效的利用,提高了微电的利用率.
2.3.2 RhB的去除率及矿化率测定MFC-EF耦合系统对RhB的去除率,评价不同阴极材料的性能,结果如图 8(a)所示.CF无负载电极、Fe & Fe2O3/CF复合电极和FeMnOx/CF复合电极在5 h的RhB去除率分别为72.27%、82.27%和91.60%,FeMnOx/CF复合电极最高.为了进一步探究CF本身对染料的吸附作用,在保证其他条件相同的情况下,进行断路状态下CF无负载电极对RhB的去除实验(图 8(a)中CF无负载电极-不通电),结果表明,在单纯的CF吸附作用下,运行5 h对RhB的去除率为47.96%.

|
图 8 不同电极所在MFC-EF耦合系统RhB去除率及TOC Fig. 8 Removal rates of RhB and TOC in MFC-EF coupling system with different electrodes |
除去CF的吸附以及原位产生的H2O2对RhB的氧化降解,Fe & Fe2O3/CF和FeMnOx/CF复合电极在RhB去除率上表现出的优势则是通过EF过程生成·OH等活性氧基团对RhB的氧化.而FeMnOx/CF复合电极对RhB的去除效果比Fe & Fe2O3/CF复合电极有提高,是由于金属锰和铁的协同作用比单一的金属铁对电芬顿反应的催化效果更好,Fe在催化H2O2产生· OH的同时,Mn也在发挥类芬顿催化作用,重要的是,在催化过程中Fe(Ⅱ)和Mn(Ⅲ)会发生反应生成Fe(Ⅲ)和Mn(Ⅱ),这一过程加速了Fe(Ⅲ)/ Fe(Ⅱ)和Mn(Ⅲ)/ Mn(Ⅱ)的氧化还原循环,从而促进了· OH的产生,增强对有机物的氧化降解.协同作用发生的具体过程为[31-32]:
| $ {\rm{Fe}}({\rm{III}}) + {{\rm{H}}_2}{{\rm{O}}_2} \to {\rm{Fe}}({\rm{II}}) + \cdot {\rm{OOH}} + {{\rm{H}}^ + }, $ | (3) |
| $ {\rm{Fe}}({\rm{II}}) + {{\rm{H}}_2}{{\rm{O}}_2} \to {\rm{Fe}}({\rm{III}}) + \cdot {\rm{OH}} + {\rm{O}}{{\rm{H}}^ - }, $ | (4) |
| $ {\rm{Mn}}({\rm{III}}) + {{\rm{H}}_2}{{\rm{O}}_2} \to {\rm{Mn}}({\rm{II}}) + \cdot {\rm{OOH}} + {{\rm{H}}^ + }, $ | (5) |
| $ {\rm{Mn}}({\rm{II}}) + {{\rm{H}}_2}{{\rm{O}}_2} \to {\rm{Mn}}({\rm{III}}) + \cdot {\rm{OH}} + {\rm{O}}{{\rm{H}}^ - }, $ | (6) |
| $ {\rm{Fe}}({\rm{II}}) + {\rm{Mn}}({\rm{III}}) \to {\rm{Fe}}({\rm{III}}) + {\rm{Mn}}({\rm{II}}). $ | (7) |
为了进一步说明耦合系统对RhB的矿化效果,测定了阴极污染物的TOC随时间变化情况,结果如图 8(b)所示.通电条件下,3种电极的TOC呈现随时间下降的趋势,FeMnOx/CF复合电极的矿化效果最好,5 h的TOC去除率达30.84%,比CF无负载电极和Fe & Fe2O3/CF复合电极分别提高了212.88%和23.92%;而不通电状态下CF无负载电极的阴极液TOC基本保持水平,无下降趋势.由此进一步说明,MFC-EF耦合系统对RhB的矿化主要依赖于EF过程,由于FeMnOx/CF复合电极可以更有效地催化EF反应,对RhB的矿化程度最高,降解效果最为彻底.同时说明本研究利用MFC产生的微电成功实现了对污染物RhB的降解,对解决MFC的应用和RhB相关染料废水的处理等问题均有重要意义.
2.4 阴极液初始pH对MFC-EF耦合系统产电性能及污染物去除效率的影响保持其他条件与2.3相同,分析阴极液初始pH对Fe & Fe2O3/CF和FeMnOx/CF复合电极所在MFC-EF耦合系统的工作电压和RhB去除率的影响.
2.4.1 阴极液初始pH对工作电压的影响图 9(a)、(b)分别为Fe & Fe2O3/CF和FeMnOx/CF复合电极在不同阴极液初始pH下的工作电压.pH在3~7,两种电极所在耦合系统的工作电压均随pH的升高而降低,但Fe & Fe2O3/CF复合电极对pH变化的响应更为明显,工作电压下降幅度更大,尤其当pH由3升至4时,工作电压平均值下降了47.04%;而FeMnOx/CF复合电极对pH的包容性更强,工作电压下降幅度很小,pH由3升至7时,工作电压平均值仅下降了21.61%,且FeMnOx/CF复合电极在pH=7时的工作电压比Fe & Fe2O3/CF复合电极pH=3时的工作电压还要高出46.90%.由此说明,如要维持Fe & Fe2O3/CF复合电极下MFC-EF耦合系统的工作电压较高,需要将pH严格限定在3附近,而FeMnOx/CF复合电极在pH=3~7内均能保证耦合系统的工作电压处于较高水平.
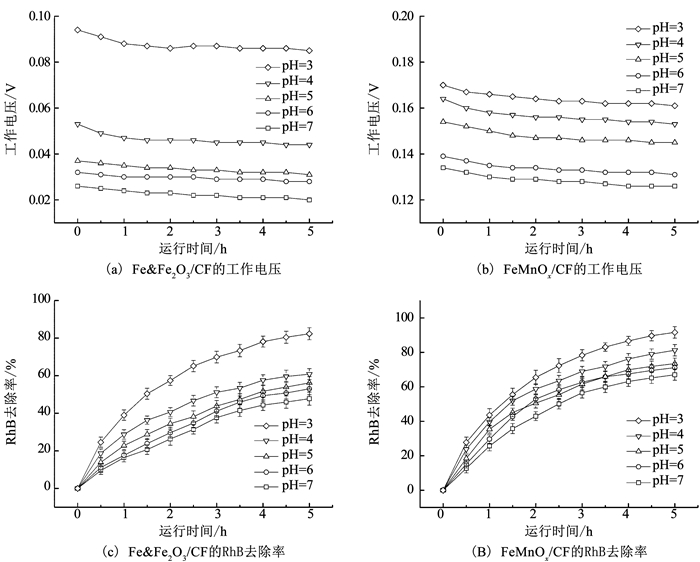
|
图 9 阴极液初始pH对不同电极所在MFC-EF耦合系统工作电压及RhB去除率的影响 Fig. 9 Effect of initial catholyte pH on working voltage and RhB removal rate in the MFC-EF coupling system with different electrodes |
图 9(c)、(d)分别为不同阴极液初始pH下Fe & Fe2O3/CF和FeMnOx/CF复合电极所在耦合系统对RhB的去除率.与电压变化规律相同,pH在3~7,两种电极对RhB的去除依然呈现随pH升高而降低的趋势.Fe & Fe2O3/CF复合电极的降低幅度更大,pH=7时5 h的RhB去除率比pH=3时下降了41.99%;FeMnOx/CF复合电极的降低幅度相对较小,pH=7时5 h的RhB去除率比pH=3时仅下降了26.86%.
按照传统Fenton反应的原理,当溶液的pH较低时,H2O2分解生成羟基自由基较多,RhB的去除率较高;另有研究[33]表明,工作电流是影响生物电芬顿体系中H2O2生成的关键因素.综合考虑pH对工作电压的影响,推断本研究中阴极液初始pH对MFC-EF耦合系统RhB去除率的影响机制,除去pH影响Fenton反应速率以外,也与pH影响耦合系统的工作电流有关.
实验还证明了FeMnOx/CF复合电极可摆脱常规Fenton体系对阴极液pH的严格限制,扩大了MFC-EF耦合系统的阴极液pH范围,解决了均相电芬顿催化的一大弊端,有望促进MFC-EF耦合工艺的实际应用.
2.5 稳定性实验电极材料的稳定性和重复利用性能是影响其应用的重要指标.图 10给出了FeMnOx/CF复合电极在MFC-EF耦合系统中循环使用6次时RhB的去除率.可以看出,循环使用过程中RhB的去除率略有下降,当重复使用6次时,FeMnOx/CF复合电极所在耦合系统对RhB的去除率由第1次的91.59%降至81.74%,说明FeMnOx/CF复合电极稳定性良好,能重复使用,同时也有提升空间,在后续研究中可以尝试通过改变材料的制备条件进一步增强其稳定性.
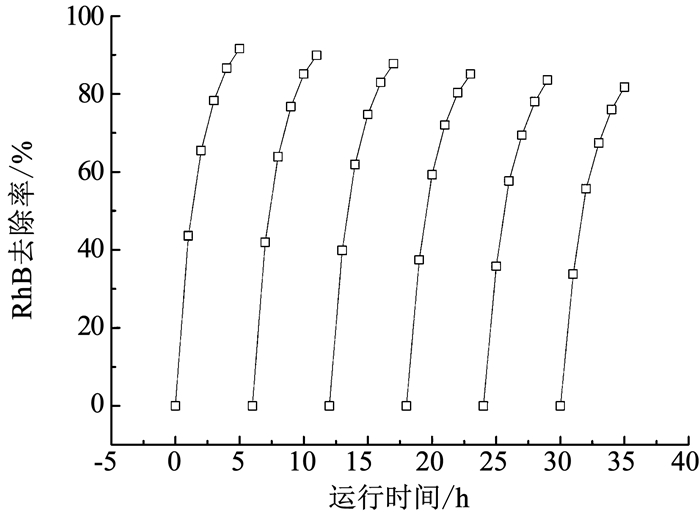
|
图 10 FeMnOx/CF复合电极的稳定性实验结果 Fig. 10 Stability test result of FeMnOx/CF composite electrode |
FeMnOx/CF复合电极作为MFC-EF耦合系统的一种阴极材料,可以在耦合系统中同时实现电能、H2O2、芬顿反应催化剂(铁离子和锰离子)的原位产生和利用,并达到降解、矿化污染物的目的.与Fe & Fe2O3/CF复合电极、CF无负载电极相比,FeMnOx/CF复合电极所在MFC-EF耦合系统的产电性能和污染物去除效率均有所提升.此外,FeMnOx/CF复合电极扩大了常规Fenton体系严格的阴极液pH范围,并具有良好的稳定性.本研究有望促进MFC-EF耦合工艺的应用,并为染料废水的处理提供新的思路.
| [1] |
LOGAN B E, HAMELERS B, ROZENDAL R, et al. Microbial fuel cells: Methodology and technology[J]. Environmental Science & Technology, 2006, 40(17): 5181. DOI:10.1021/es0605016 |
| [2] |
卢娜, 周顺桂, 倪晋仁. 微生物燃料电池的产电机制[J]. 化学进展, 2008(增刊2): 1233. LU Na, ZHOU Shungui, NI Jinren. Mechanism of energy generation of microbial fuel cells[J]. Progress in Chemistry, 2008(S2): 1233. |
| [3] |
MALAEB L, KATURI K P, LOGAN B E, et al. A hybrid microbial fuel cell membrane bioreactor with a conductive ultrafiltration membrane biocathode for wastewater treatment[J]. Environmental Science & Technology, 2013, 47(20): 11821. DOI:10.1021/es4030113 |
| [4] |
LI X, SONG H, XIANG W, et al. Electricity generation during wastewater treatment by a microbial fuel cell coupled with constructed wetland[J]. Journal of Southeast University, 2012, 28(2): 175. DOI:10.3969/j.issn.1003-7985.2012.02.008 |
| [5] |
WANG Y P, ZHANG H L, LI W W, et al. Improving electricity generation and substrate removal of a MFC-SBR system through optimization of COD loading distribution[J]. Biochemical Engineering Journal, 2014, 85: 15. DOI:10.1016/j.bej.2014.01.008 |
| [6] |
NIDHEESH P V, GANDHIMATHI R. Trends in electro-Fenton process for water and wastewater treatment: An overview[J]. Desalination, 2012, 299: 1. DOI:10.1016/j.desal.2012.05.011 |
| [7] |
MOREIRA F C, BOAVENTURA R A R, BRILLAS E, et al. Electrochemical advanced oxidation processes: A review on their application to synthetic and real wastewaters[J]. Applied Catalysis B: Environmental, 2017, 202: 217. DOI:10.1016/j.apcatb.2016.08.037 |
| [8] |
ROZENDAL R A, LEONE E, KELLER J, et al. Efficient hydrogen peroxide generation from organic matter in a bioelectrochemical system[J]. Electrochemistry Communications, 2009, 11(9): 1752. DOI:10.1016/j.elecom.2009.07.008 |
| [9] |
LI X, CHEN S, ANGELIDAKI I, et al. Bio-electro-Fenton processes for wastewater treatment: Advances and prospects[J]. Chemical Engineering Journal, 2018, 354: 492. DOI:10.1016/j.cej.2018.08.052 |
| [10] |
FU L, YOU S, YANG F, et al. Synthesis of hydrogen peroxide in microbial fuel cell[J]. Journal of Chemical Technology & Biotechnology, 2010, 85(5): 715. DOI:10.1002/jctb.2367 |
| [11] |
ZHU X, NI J. Simultaneous processes of electricity generation and p-nitrophenol degradation in a microbial fuel cell[J]. Electrochemistry Communications, 2009, 11(2): 274. DOI:10.1016/j.elecom.2008.11.023 |
| [12] |
TAO H C, WEI X Y, ZHANG L J, et al. Degradation of p-nitrophenol in a BES-Fenton system based on limonite[J]. Journal of Hazardous Materials, 2013, 254: 236. DOI:10.1016/j.jhazmat.2013.03.061 |
| [13] |
ZHUANG L, ZHOU S, YUAN Y, et al. A novel bioelectro-Fenton system for coupling anodic COD removal with cathodic dye degradation[J]. Chemical Engineering Journal, 2010, 163(1/2): 160. DOI:10.1016/j.cej.2010.07.039 |
| [14] |
FENG C H, LI F B, MAI H J, et al. Bio-electro-Fenton process driven by microbial fuel cell for wastewater treatment[J]. Environmental Science & Technology, 2010, 44(5): 1875. DOI:10.1021/es9032925 |
| [15] |
YONG X Y, GU D Y, WU Y D, et al. Bio-Electron-Fenton (BEF) process driven by microbial fuel cells for triphenyltin chloride (TPTC) degradation[J]. Journal of Hazardous Materials, 2017, 324: 178. DOI:10.1016/j.jhazmat.2016.10.047 |
| [16] |
南继林, 许炉生, 徐泽海, 等. 非均相电芬顿法处理废水的研究进展[J]. 浙江化工, 2017, 48(10): 39. NAN Jilin, XU Lusheng, XU Zehai, et al. Research progress of heterogeneous electro-Fenton process for wastewater treatment[J]. Zhejiang Chemical Industry, 2017, 48(10): 39. DOI:10.3969/j.issn.1006-4184.2017.10.012 |
| [17] |
BOKARE A D, CHOI W. Review of iron-free Fenton-like systems for activating H2O2 in advanced oxidation processes[J]. Journal of Hazardous Materials, 2014, 275: 121. DOI:10.1016/j.jhazmat.2014.04.054 |
| [18] |
高佳, 李娜, 方雪, 等. 铁酸锰纳米材料的制备及其对直接黑38的类芬顿催化降解研究[J]. 四川环境, 2016, 35(3): 8. GAO Jia, LI Na, FANG Xue, et al. Preparation of manganese ferrite nanoparticles and its Fenton-like catalytic degradation on direct black 38[J]. Sichuan Environment, 2016, 35(3): 8. DOI:10.14034/j.cnki.schj.2016.03.002 |
| [19] |
LI J, AI Z, ZHANG L. Design of a neutral electro-Fenton system with Fe@Fe2O3/ACF composite cathode for wastewater treatment[J]. Journal of Hazardous Materials, 2009, 164(1): 18. DOI:10.1016/j.jhazmat.2008.07.109 |
| [20] |
张敏, 朱波, 王成国, 等. 用SEM研究碳纤维的表面及断口形貌[J]. 功能材料, 2010, 41(10): 1731. ZHANG Min, ZHU Bo, WANG Chengguo, et al. Surface and fracture morphologies of carbon fibers observed by SEM[J]. Journal of Functional Materials, 2010, 41(10): 1731. |
| [21] |
ZHU L, AI Z, HO W, et al. Core-shell Fe-Fe2O3 nanostructures as effective persulfate activator for degradation of methyl orange[J]. Separation and Purification Technology, 2013, 108: 159. DOI:10.1016/j.seppur.2013.02.016 |
| [22] |
WANG S, FU J, WANG K, et al. Large-scale preparation of Fe@Fe2O3 nanoscale stirring bars with ultrahigh saturation magnetization[J]. Materials Letters, 2017, 209: 576. DOI:10.1016/j.matlet.2017.08.103 |
| [23] |
MIYAKOSHI A, UENO A, ICHIKAWA M. XPS and TPD characterization of manganese-substituted iron-potassium oxide catalysts which are selective for dehydrogenation of ethylbenzene into styrene[J]. Applied Catalysis A: General, 2001, 219(1/2): 249. DOI:10.1016/S0926-860X(01)00697-4 |
| [24] |
ZHUANG L, ZHOU S, YUAN Y, et al. A novel bioelectro-Fenton system for coupling anodic COD removal with cathodic dye degradation[J]. Chemical Engineering Journal, 2010, 163(1/2): 160. DOI:10.1016/j.cej.2010.07.039 |
| [25] |
ZHANG Y, WANG Y, ANGELIDAKI I. Alternate switching between microbial fuel cell and microbial electrolysis cell operation as a new method to control H2O2 level in bioelectro-Fenton system[J]. Journal of Power Sources, 2015, 291: 108. DOI:10.1016/j.jpowsour.2015.05.020 |
| [26] |
FU L, YOU S J, ZHANG G, et al. Degradation of azo dyes using in-situ Fenton reaction incorporated into H2O2-producing microbial fuel cell[J]. Chemical Engineering Journal, 2010, 160(1): 164. DOI:10.1016/j.cej.2010.03.032 |
| [27] |
赵庆良, 姜珺秋, 王琨, 等. 微生物燃料电池处理剩余污泥与同步产电性能[J]. 哈尔滨工程大学学报, 2010, 31(6): 780. ZHAO Qingliang, JIANG Junqiu, WANG Kun, et al. Simultaneous treatment of sludge and generation of electricity with a microbial fuel cell[J]. Journal of Harbin Engineering University, 2010, 31(6): 780. DOI:10.3969/j.issn.1006-7043.2010.06.017 |
| [28] |
李魁忠.海底微生物燃料电池铁/锰改性电极及产电性能研究[D].青岛: 中国海洋大学, 2011 LI Kuizhong. Studies on iron/manganese modified electrodes and current-producing properties in benthonic microbial fuel cells[D]. Qingdao: Ocean University of China, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10423-1011229148.htm |
| [29] |
周蕾.电芬顿阴极材料的制备与转盘工艺的研究[D].天津: 南开大学, 2013 ZHOU Lei. Preparation of cathodic materials and investigation of rotating disk reactor for electro-fenton system[D]. Tianjin: Nankai University, 2013 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=y2420688 |
| [30] |
PENG X, QU J, TIAN S, et al. Green fabrication of magnetic recoverable graphene/MnFe2O4 hybrids for efficient decomposition of methylene blue and the Mn/Fe redox synergetic mechanism[J]. RSC Advances, 2016, 6(106): 104549. DOI:10.1039/c6ra24320g |
| [31] |
ZHAO J, YANG J, MA J. Mn (Ⅱ)-enhanced oxidation of benzoic acid by Fe(Ⅲ)/H2O2 system[J]. Chemical Engineering Journal, 2014, 239: 171. DOI:10.1016/j.cej.2013.11.014 |
| [32] |
NGUYEN T D, PHAN N H, DO M H, et al. Magnetic Fe2MO4 (M: Fe, Mn) activated carbons: Fabrication, characterization and heterogeneous Fenton oxidation of methyl orange[J]. Journal of Hazardous Materials, 2011, 185(2/3): 653. DOI:10.1016/j.jhazmat.2010.09.068 |
| [33] |
XU P, XU H, SHI Z. A novel bio-electro-Fenton process with FeVO4/CF cathode on advanced treatment of coal gasification wastewater[J]. Separation and Purification Technology, 2018, 194: 457. DOI:10.1016/j.seppur.2017.11.073 |
 2020, Vol. 52
2020, Vol. 52


