2. 南京大学环境学院, 污染控制与资源化研究国家重点实验室,南京 210093
2. State Kay Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210093, China
乙酰氨基酚(acetaminophen,APAP)具有解热镇痛的作用,是全世界使用量最高的非甾体抗炎药物[1],通过生物代谢物及过期或未用完废弃物进入环境,导致其在污水处理厂、自然水环境、土壤中频频检出,APAP在污水处理厂的出水中质量浓度可达到8 025 ng/L[2].APAP是中国近45个污水处理厂活性污泥的主要污染物之一[3].含有微量的APAP水体经过加氯消毒后会产生毒性更大的苯醌类物质[4];APAP在水环境药物风险评价中风险值大于1,质量浓度超出了无生态风险浓度值[5-6], 其残留已对水生生态系统和人体构成潜在危害[7-9],对其去除成为环境研究中的一个热点问题[10].目前,国内外研究用于降解APAP的方法主要有高级氧化法、TiO2光催化、生物降解[11-16]等.其中,生物降解法由于不存在二次污染以及成本低等备受关注.
生物锰氧化物是由锰氧化细菌如恶臭假单胞球菌(Pseudomonas Putida)、纤发菌属(Leptothrix)、锰土微菌(Pedomicrobium manganicum)等以O2为电子受体,通过多铜氧化酶(MCOs) 将Mn(Ⅱ)氧化为Mn(Ⅳ)而形成高价态锰生物氧化物(BioMnOx).BioMnOx作为锰氧化细菌形成的初级产物,基本单元是Mn(Ⅳ)O6的正八面体结构,存在包括Mn(Ⅳ)空缺位点和晶体的边缘及内层位点,Mn(Ⅳ)/Mn(Ⅱ)间的氧化还原电位及强氧化剂Mn(Ⅲ)为中间体的单电子转移,使其具有较强的氧化能力[17].因此,BioMnOx同时展现了较强的氧化和吸附能力.Pseudomonas sp.作为锰氧化的模式菌株,其形成的锰氧化物已应用到多种重金属和有机物氧化去除的研究中.Owen[18]研究了Pseudomonas putida GB-1产生的BioMnOx对草铵铁的吸附,发现Fe(Ⅲ)在多个位点特异性地吸附到矿物结构上.菅之舆等[19]在以锰氧化细菌Pseudomonas sp.QJX-1构建的生物体系中,通过Pseudomonas sp.QJX-1生成的BioMnOx有效去除2-羟基-4-甲氧基二苯甲酮-5-磺酸(BP-4).Zhang等[7]通过在锰砂/石英砂好氧生物滤池启动时引入Pseudomonas sp.形成BioMnOx生物膜,对卡马西平、双氯芬酸等通过开苯环降解.以往研究基于对实际工艺的模拟,对Pseudomonas的不同菌株BioMnOx在水处理反应体系中,或对有机物氧化、或对重金属吸附进行了宏观评价.然而,实际水体中存在着多种金属离子,在被吸附占据吸附位点同时对BioMnOx氧化有机物的影响鲜有研究.另外,BioMnOx具有较高的吸附及氧化活性,其微观结构和活性会随时间快速变化,Pseudomonas的菌株活性、BioMnOx的形成过程及结构变化等对吸附和有机物的降解影响相关性研究,对于生物铁锰反应器的参数设计及启动运行具有重要意义.
本研究以具有强锰氧化能力的Pseudomonas putida作为模式菌种, 以水体中常见的Fe(Ⅲ)为共存离子,通过研究P.putida形成锰氧化物的过程对Fe(Ⅲ)的吸附及对APAP降解效率,确定BioMnOx吸附过程对氧化能力的影响;提出BioMnOx生物量对APAP降解的动力学并推断APAP的降解途径,为BioMnOx应用于水体残留非甾体药物类的去除提供新思路及理论支撑.
1 实验 1.1 实验试剂实验中所用药品有乙酰氨基酚(acetaminophen,APAP)(纯度>99.0%,上海润捷化学试剂有限公司)、四氢呋喃(99.9%,J & K Chemical)、N-O双(三甲基硅烷基)三氟乙酰胺(BSTFA, 99%,TCI),其他无机试剂均为分析纯或优级纯,甲醇、乙腈等有机试剂均为色谱纯.
1.2 生物锰氧化物的形成实验所用菌株为恶臭假单胞菌(Pseudomonas putida QYS-1,CGMCCNO: 14390),从某除铁锰的生物滤池中筛选分离出来.
培养基成分(g/L):蛋白胨0.8,酵母浸粉0.2,K2HPO4 0.1,MgSO4·7H2O 0.2,NaNO3 0.2,CaCl2 0.1,NH4Cl 0.1,MnSO4 · H2O 0.2.配置一定量的培养基,然后用饱和NaOH调节pH(7.1~7.2),分装后放于灭菌器中121 ℃灭菌30 min. 然后将其转入生物安全柜中,冷却至室温.取100 mL装入锥形瓶中,将Pseudomonas putida QYS-1母液以1%的接种量接入,然后将其置于恒温振荡器中培养(温度25 ℃,转速125 r/min),培养40 h,每隔2 h取样.测其OD600监测生物锰氧化物的形成过程.取上层清液测铁锰离子质量浓度,考察BioMnOx形成过程对Fe(Ⅲ)吸附的影响.
1.3 BioMnOx的制备配置一批培养基,以相同的条件灭菌冷却,将母液以1%的接种量接入新配置的培养基中,将其置于恒温振荡器中培养(温度25 ℃,转速125 r/min)40 h左右生成黑色颗粒沉淀,即培养完全.将培养完全的培养基转入灭菌的离心管中,置于高速离心机中离心20 min(温度25 ℃,转速5 000 r/min),弃掉上清液用无菌水反复水洗3次,反复离心,得到BioMnOx.
1.4 BioMnOx的形成过程中Fe(Ⅲ)吸附及APAP氧化相互影响配置一定量的培养基,加入不同质量浓度的APAP溶液(10,100 mg/L)、Fe(Ⅲ)以柠檬酸铁铵形式加入(1 g/L)以及1%的恶臭假单胞菌母液,同时设置3组平行样.将Pseudomonas putida接入的时间记为零时刻,每隔一定时间取样.通过HPLC和ICP-OES测定溶液中不同时刻APAP的剩余质量浓度和Fe(Ⅲ)质量浓度,考察BioMnOx形成过程中Fe(Ⅲ)吸附及APAP氧化相互影响.
另外,配置不同Mn2+质量浓度(8.13,16.25,24.38,32.50 mg/L)的培养基,接种1%的Pseudomonas putida母液,每组设置3个平行样.不同量的BioMnOx生成后离心收集,加入APAP溶液中,将BioMnOx接入的时间记为零时刻,每隔一定时间取样,检测剩余APAP质量浓度,以此探讨BioMnOx的量对APAP氧化的影响.
1.5 Pseudomonas putida对APAP的氧化活性制备6组相同条件下生成的BioMnOx,振荡离心后弃掉上清液,将BioMnOx与10 mg/L APAP的无菌溶液混合,同时向其中3瓶加入50 mg/L的叠氮化钠,作为抑制组1,其余3瓶不加作为对照组1[9].将其置于恒温振荡器中振荡(温度25 ℃;转速125 r/min).将加入BioMnOx的时间记为零时刻,在振荡2 h及24 h时各取一次样,测定溶液中APAP质量浓度.通过两组APAP去除情况的比较,探讨Pseudomonas putida的氧化活性对Fe(Ⅲ)吸附及APAP氧化的影响.
振荡24 h后,将两组溶液分别超声1 h,取其上清液检测溶液中铁锰质量浓度,探讨其在APAP降解过程中的作用.
1.6 降解产物分析配置一定质量浓度的APAP溶液,加入生成的BioMnOx,将BioMnOx接入的时间记为零时刻,每隔一定时间取样,通过GC-MS系统分析降解产物.
1.7 分析方法 1.7.1 样品分析实验中不同时刻所取的样品于20 ℃、4 000 r/min条件下离心20 min,上清液经0.22 μm滤膜过滤后于4 ℃下保存,用于后续实验分析.
APAP质量浓度通过HPLC-UV系统分析,配置反向C18高效液相色谱柱(150×4.6 mm,5 μm).柱温设为30 ℃,进样量20 μL.流动相,V(甲醇)∶V(超纯水)(含0.05%冰乙酸)=20∶ 80,流速0.5 mL/min,检测波长240 nm[9].
溶液中铁锰离子质量浓度通过电感耦合等离子体发射光谱仪(ICP-OES)测定.
1.7.2 动力学实验对APAP的降解、Mn2+的氧化过程进行一级反应动力学拟合,反应速率方程如下
| $ - \frac{{{\rm{d}}\rho }}{{{\rm{d}}t}} = k\rho . $ | (1) |
积分形式为
| $ {\rm{ln}}\frac{{{\rho _0}}}{\rho } = Kt. $ | (2) |
式中:t为时间,h;ρ为t时刻APAP或Mn2+的质量浓度,mg/L;ρ0为0时刻APAP或Mn2+的质量浓度,mg/L;K为反应速率常数.
1.7.3 降解产物分析采用GC-MS分析主要降解产物,GC-MS条件[20]:进样口温度280 ℃,采用程序升温,初始60 ℃,保持3 min,然后以10 ℃/min升至280 ℃,保持3 min;He为载气,流量1 mL/min,分流20 mL/min,进样量1 μL;EI源为电离源,70 eV.样品前处理:取水样150 μL,加入气相色谱瓶中,以轻柔的氮气吹干,然后加入150 μL无水四氢呋喃和60 μL BSTFA,加盖密封后置于40 ℃烘箱中衍生30 min,用于GC-MS分析.
1.7.4 BioMnOx表征方法分别收集培养24,44 h时的BioMnOx,将其置于冷冻干燥机中冷冻干燥,分别取少许置于电镜样品台上作喷金处理,然后采用扫描电镜(SEM,Quanta FEG 250,美国)、透射电镜(TEM,Talos F200 X,美国)对BioMnOx的微观结构进行观察.
2 结果与讨论 2.1 BioMnOx的形成过程从P.putida QSY-1接种至6 h,培养基保持澄清透明,颜色为橙黄色,从6 h起培养基溶液颜色加深,为红棕色,观测到10 h无明显沉淀,但溶液逐渐浑浊;从10 h起开始逐渐出现棕黑色锰沉淀物,到20 h之间培养基呈黑褐色胶体状溶液,静置不分层;20 h后大量絮状棕黑色沉淀逐渐积累,静置后固液边界清晰,上清液澄清透明;由图 2可知, OD600也与观测现象吻合,在6~18 h呈线性递增,20 h后OD600几乎不再增加,但误差棒增大,是因为锰氧化物颗粒变化较大,培养基由乳浊液变化至可分离悬浊态,说明BioMnOx在形成过程中自身结构发生变化.
BioMnOx生成过程中的微观结构变化见图 1.可以看出,在BioMnOx形成初期,BioMnOx表面较为平整,但内部嵌布颗粒,粒径较小,直径约为49.9 nm,可见此时生物氧化形成的锰氧化物结晶较弱[21],由TEM图可以看出,BioMnOx为无定型的纳米颗粒.在24~44 h,BioMnOx结构发生了变化,由平整演变为密集、突出的颗粒状,颗粒边界更为清晰,粒径约70 nm.Tebo等研究发现生物锰氧化物初级产物的晶体结构会随时间发生变化,在初级产物中共存着正六边形和假直角型两种晶体结构.12 h时正六边形结构占主导,之后假直角结构逐渐变成主导[22].

|
图 1 不同时刻BioMnOx的TEM结构 Fig. 1 TEM structures of BioMnOx at different time points |
由图 2可知,溶解性锰离子在0~10 h质量浓度变化较小,10~20 h迅速降低,从44.44 mg/L降至0.86 mg/L,尤其是在14~16 h,2 h内减少了40.8 mg/L.Mn离子的急剧减少并非是Mn离子的完全氧化,因为OD600在2 h内没有急剧增加,仍处于线性递增,Mn离子的急剧减少应源于BioMnOx对Mn离子的吸附.Forrez等[23]观察到锰氧化物形成过程中表面可吸附大量的Mn离子,培养20 h时Mn2+/Mn4+的比率为0.57 mg/mg.20 h后,Mn离子质量浓度再次处于缓慢降低的过程,最终Mn离子质量浓度稳定在0.15 mg/L左右.

|
图 2 锰氧化物的形成 Fig. 2 Formation of manganese oxide |
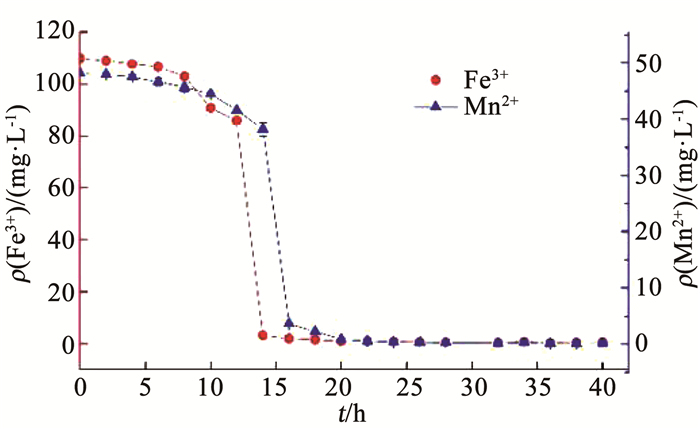
由图 3可知,BioMnOx对Fe(Ⅲ)的吸附发生在对APAP的氧化之前.在APAP的共存体系中,无论APAP是低或高质量浓度(10,100 mg/L),Fe(Ⅲ)的质量浓度变化趋势一致,即0~12 h质量浓度变化不大,保持在123 mg/L左右,而12~16 h急剧下降至1.3 mg/L左右,在20 h后少量回增又下降至稳定,保持在1.2 mg/L左右.12~16 h是锰氧化物初级产物形成期,其结构正逐渐由正六边形演化至假直角型[22],Tebo等[22]研究发现后者中的Mn(Ⅳ)缺位较少,而Mn(Ⅳ)空缺位点的数量直接影响到吸附能力.因此,在12~16 h BioMnOx对Fe(Ⅲ)显示出较强的吸附性能,16~20 h则保持稳定.20 h以后APAP开始被BioMnOx氧化,部分Mn(Ⅳ)氧化物作为电子受体转化为溶解性的Mn(Ⅱ),结构改变致使吸附位点减少,已吸附的Fe(Ⅲ)被解吸释放.通过比较10及100 mg/L的APAP体系可知,在100 mg/L体系中Fe(Ⅲ)的释放量(22.4 mg/L)几乎为10 mg/L体系中(2.8 mg/L)的10倍.吸附后期随着P.putida的氧化作用,持续地将Mn2+转化为BioMnOx,继而对释放的Fe(Ⅲ)重新吸附至接近1.2 mg/L.因此,APAP与Fe(Ⅲ)共存时,BioMnOx对APAP的氧化影响了对Fe(Ⅲ)的吸附,致使其发生解吸,但解吸可通过持续的BioMnOx生成而消除.

|
图 3 不同初始质量浓度APAP与Fe3+、Mn2+质量浓度随时间的变化 Fig. 3 Variation of concentrations of Fe3+ and Mn2+ with time under different initial concentrations of APAP |
BioMnOx对APAP的氧化滞后于对Fe(Ⅲ)急剧吸附,即在18 h左右APAP开始被氧化,此时溶液中已形成明显的固态BioMnOx,且Fe(Ⅲ)已分别降至3.2,2.5 mg/L.10及100 mg/L的APAP降解趋势相似,即在18~28 h均呈线性降解,对其进行一级反应动力学拟合(图 4), 一级反应线性相关系数均较好(R102=0.93;R1002=0.982), 表明APAP在18~28 h降解反应均符合一级反应动力学模型.APAP质量浓度为10, 100 mg/L时, 一级反应速率常数(K)分别为0.241 08和0.084 57 h-1(表 1).表明100 mg/L质量浓度下APAP的降解速率慢,故10 mg/L APAP在24 h内就能实现完全降解,而100 mg/L APAP至少需要52 h左右才能完全降解.
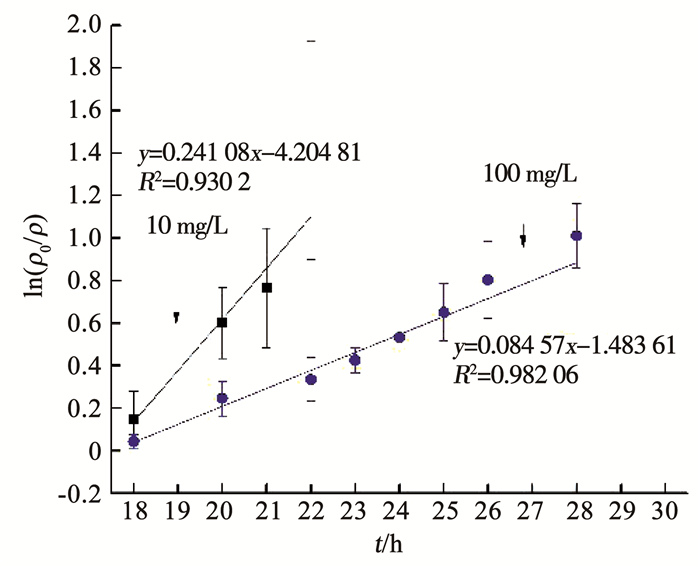
|
图 4 降解速率曲线 Fig. 4 Degradation rate curve |
| 表 1 APAP降解及锰氧化过程一级动力学方程参数 Tab. 1 Parameters of first-order kinetic equation for APAP degradation and manganese oxidation |
APAP的存在对Mn2+的变化规律亦产生了影响.由图 5可知,在只有Fe3+存在而无APAP时,Mn2+在14~16 h由38.2 mg/L急剧减少至3.62 mg/L,然而在APAP存在时,Mn2+减少速率放缓(图 3).为分析APAP质量浓度对Mn2+氧化速率的影响,取图 3(a)中18~23 h、图 3(b)中18~30 h Mn2+的氧化速率进行一级反应动力学拟合,反应速率方程拟合曲线如图 6所示,可以看出,Mn2+的氧化速率符合一级动力学方程,且速率常数与相对应质量浓度的APAP氧化速率常数接近,即10,100 mg/L APAP质量浓度下的Mn2+氧化速率常数KMn分别为0.760 55和0.134 36 h-1,K(Mn, 10)远大于K(Mn, 100),同时K(APAP, 10)也远大于K(APAP, 100)(表 1),表明100 mg/L质量浓度下的Mn2+氧化速率低,导致该质量浓度下APAP的降解速率较慢.锰氧化速率的降低应该是由APAP对Pseudomonas putida生长抑制作用导致, 本课题组前期实验表明,高质量浓度下(100 mg/L)的APAP对Pseudomonas putida生长有抑制作用,100 mg/L的APAP培养基中细菌数量较10 mg/L减少了约75%,因此,对Mn2+的氧化速率产生影响,进而导致高质量浓度APAP降解速率降低.
|
图 5 无APAP存在时铁锰离子质量浓度变化 Fig. 5 Variation of concentrations of Fe3+ and Mn2+ in the absence of APAP |

|
图 6 Mn2+氧化速率曲线 Fig. 6 Mn2+ oxidation rate curve |
在Pseudomonas putida氧化Mn2+生成BioMnOx过程中,虽然对Fe(Ⅲ)的吸附先于对APAP的氧化,但对Fe(Ⅲ)的吸附并未对APAP的氧化速率产生影响;APAP的氧化过程中则会导致Fe(Ⅲ)解吸的发生,但新增的BioMnOx可对Fe(Ⅲ)再吸附;APAP质量浓度增加可抑制Mn2+的氧化速率来减缓APAP的降解速率.因此,Pseudomonas putida对Mn2+的氧化活性及BioMnOx的量将会对APAP降解造成影响.
2.3 Pseudomonas putida的氧化活性对Fe(Ⅲ)吸附及APAP氧化的影响本实验利用叠氮化钠抑制Pseudomonas putida的活性[9].由图 7可知,Pseudomonas putida的活性被抑制后APAP的降解效果变差,反应2 h时,对照组1中APAP的去除率为72%,而抑制组1中其去除率只有33%,反应24 h时,对照组1中APAP的去除率达100%,实现完全降解,而抑制组1中APAP的去除率与反应2 h时相比几乎没有变化,说明Pseudomonas putida Mn2+氧化活性的抑制严重影响了APAP的降解.Sabirova等[24]也发现了叠氮化钠可以抑制Pseudomonas putida的活性使其降解17α-炔雌醇的能力变差,这是因为由于叠氮化钠的抑制作用,Pseudomonas putida活性受到抑制后就无法继续氧化培养基中的Mn2+,使得培养基丧失持续产生BioMnOx的能力,进而导致有机污染物不能被完全降解.所以,抑制组1中APAP的去除率没有随反应时间的延长而有所变化.抑制组1中反应2 h时达到的33%的去除率可能是加入叠氮化钠前培养基中已经生成的BioMnOx作用的结果.以上证明APAP质量浓度的增加可以抑制培养基中Mn2+的氧化速率进而减缓APAP的去除速率.
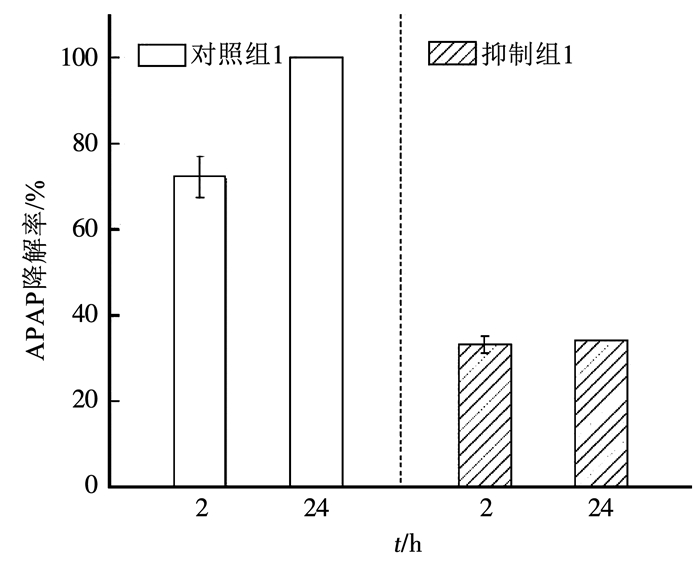
|
图 7 APAP降解效率 Fig. 7 Degradation efficiency of APAP |
对照组1和抑制组1超声后检测溶液中溶解性铁锰离子质量浓度,结果显示两组中铁离子质量浓度均非常低,约为零,这表明Pseudomonas putida的氧化活性抑制对BioMnOx吸附没有产生影响.抑制组1中Mn2+质量浓度平均为9.3 mg/L,对照组1中Mn2+质量浓度仅为0.5 mg/L.这也表明BioMnOx对Fe(Ⅲ)的吸附并非为与Mn2+的离子交换机制.结合上文实验结果,对照组1中APAP的去除率达100%,而抑制组1中APAP的去除率仅达33%,这说明培养基中Mn2+的持续氧化是实现APAP能够达到完全降解的重要因素.对照组中由于BioMnOx表面负载少量Mn2+,在与APAP溶液混合后,表面的Mn2+不断被释放出来,Pseudomonas putida持续氧化Mn2+,继而生成新的BioMnOx,不断生成的BioMnOx能够促使溶液中的APAP持续降解,所以,对照组1中的APAP去除效果较抑制组1更为显著,同时,由于培养基中Mn2+被不断消耗生成新的BioMnOx,其超声后的质量浓度较低.而抑制组1中,由于Pseudomonas putida的活性被抑制,进而Mn2+氧化作用被抑制,不能生成新的BioMnOx,APAP的降解只能由培养基中原有的BioMnOx来实现,由于原有的BioMnOx量很少,抑制组1中的APAP不能实现完全降解,超声后的Mn2+质量浓度也比对照组1中的高.因此,BioMnOx量对APAP的氧化产生一定影响.
2.4 BioMnOx量对APAP氧化的影响BioMnOx量对APAP氧化速率常数的线性关系采用一级反应动力学进行拟合(见图 8和表 2),其相关系数均较好(R2=0.92~0.99),符合一级反应动力学模型.Mn2+质量浓度为24.38,32.50 mg/L时所生成的BioMnOx能够在14 h内实现APAP降解完全,而Mn2+质量浓度为8.13,16.25 mg/L时所生成的BioMnOx分别在24,18 h时才能实现APAP降解完全,说明APAP所需完全降解的时间与生成的BioMnOx的量成正相关.

|
图 8 速率常数曲线 Fig. 8 Rate constant curve |
| 表 2 速率常数曲线参数 Tab. 2 Rate constant curve parameters |
采用GC-MS对APAP氧化降解的中间产物进行分析[12],结果列于表 3,根据表 3推测APAP氧化降解可能的降解途径,结果见图 9.
| 表 3 APAP降解的中间产物结构推测 Tab. 3 Conjecture about structures of intermediate products in APAP degradation |

|
图 9 APAP氧化降解可能的降解途径 Fig. 9 Possible degradation pathways of APAP oxidative degradation |
首先APAP苯环上的乙酰基被取代生成乙酰胺(1)、对氨基苯酚和对苯二酚(6),(1)进一步被氧化为乙醇酸(2),继而生成乙二酸(3),最终氧化为二氧化碳和水;同时对氨基苯酚的-NH2被取代生成(6),之后(6)脱下羟基生成苯醌(7),(7)进一步开环裂解、双键打开生成顺丁烯二酸,顺丁烯二酸继续被氧化生成(3)[25],最终被矿化为二氧化碳和水,或者对氨基苯酚被氧化生成苯醌亚胺(4),进一步再生成(7),然后重复上述降解途径;(6)同时被氧化生成(7)和丁二酸(5),(5)继续氧化生成(3),而(7)重复上述降解途径,最终生成二氧化碳和水.
3 结论1) BioMnOx为无定型的纳米颗粒,在形成过程中自身结构发生变化,表面由平整变为密集、突出的颗粒状,颗粒边界更为清晰,颗粒粒径从约49.9 nm长至约70 nm.BioMnOx在形成过程中Mn离子的急剧减少主要是由于BioMnOx对Mn离子的吸附.
2) BioMnOx形成过程中对Fe(Ⅲ)的吸附发生在对APAP的氧化之前,但对Fe(Ⅲ)的吸附并未对APAP的氧化速率产生显著影响.APAP氧化降解过程以及不同APAP质量浓度对Mn2+氧化速率影响过程均符合一级动力学方程.
3) APAP质量浓度增加可抑制Mn2+的氧化速率来减缓APAP的降解速率.Pseudomonas putida对Mn2+的氧化活性及BioMnOx的量对APAP降解有一定的影响.
4) 在APAP氧化降解过程中,生成了对苯二酚、乙酰胺、对氨基苯酚等一系列产物,随后继续被氧化为结构更简单的有机物,最后生成CO2和H2O,实现APAP的降解.
| [1] |
张伦. 扑热息痛市场分析[J]. 中国药房, 2002, 13(1): 11. ZHANG Lun. Market analysis of paracetamol[J]. China Pharmacy, 2002, 13(1): 11. DOI:10.3969/j.issn.1001-0408.2002.01.003 |
| [2] |
VEACH A M, BERNOT M J. Temporal variation of pharmaceuticals in an urban and agriculturally influenced stream[J]. Science of the Total Environment, 2011, 409(21): 4553. DOI:10.1016/j.scitotenv.2011.07.022 |
| [3] |
GIBSON R, DURAN-ÁLVAREZ J C, ESTRADA K L, et al. Accumulation and leaching potential of some pharmaceuticals and potential endocrine disruptors in soils irrigated with wastewater in the Tula Valley, Mexico[J]. Chemosphere, 2010, 81(11): 1437. DOI:10.1016/j.chemosphere.2010.09.006 |
| [4] |
BEDNER M, MACCREHAN W A. Transformation of acetaminophen by chlorination produces the toxicants 1, 4-benzoquinone and N-acetyl-p-benzoquinone imine[J]. Environmental Science & Technology, 2006, 40(2): 516. DOI:10.1021/es0509073 |
| [5] |
SANTOS J L, APARICIO I, ALONSO E. Occurrence and risk assessment of pharmaceutically active compounds in wastewater treatment plants. A case study: Seville city (Spain)[J]. Environment International, 2007, 33(4): 596. DOI:10.1016/j.envint.2006.09.014 |
| [6] |
STUER-LAURIDSEN F, BIRKVED M, HANSEN L P, et al. Environmental risk assessment of human pharmaceuticals in Denmark after normal therapeutic use[J]. Chemosphere, 2000, 40(7): 783. DOI:10.1016/S0045-6535(99)00453-1 |
| [7] |
ZHANG Yongjun, ZHU Hong, SZEWZYK U, et al. Removal of pharmaceuticals in aerated biofilters with manganese feeding[J]. Water Research, 2015, 72: 218. DOI:10.1016/j.watres.2015.01.009 |
| [8] |
JONES O A, LESTER J N, VOULVOULIS N. Pharmaceuticals: A threat to drinking water?[J]. Trends in Biotechnology, 2005, 23(4): 163. DOI:10.1016/j.tibtech.2005.02.001 |
| [9] |
黄馨. 铁锰对Pseudomonas putida降解单苯环非甾体抗炎药的影响[D]. 天津: 天津理工大学, 2017 HUANG Xin. Effects of Fe and Mn on single benzene ring nonsteroidal anti-inflammatory drugs degradation by Pseudomonas putida[D]. Tianjin: Tianjin University of Technology, 2017 |
| [10] |
孙向阳, 胡正峰, 孙璐, 等. 典型PhACs的检测分析方法研究进展[J]. 黑龙江科学, 2016, 7(23): 6. SUN Xiangyang, HU Zhengfeng, SUN Lu, et al. Review of detection and analysis methods of typical PhACs[J]. Heilongjiang Science, 2016, 7(23): 6. DOI:10.3969/j.issn.1674-8646.2016.23.003 |
| [11] |
BRILLAS E, SIRÉS I, ARIAS C, et al. Mineralization of paracetamol in aqueous medium by anodic oxidation with a boron-doped diamond electrode[J]. Chemosphere, 2005, 58(4): 399. DOI:10.1016/j.chemosphere.2004.09.028 |
| [12] |
ANDREOZZI R, CAPRIO V, MAROTTA R, et al. Paracetamol oxidation from aqueous solutions by means of ozonation and H2O2/UV system[J]. Water Research, 2003, 37(5): 993. DOI:10.1016/S0043-1354(02)00460-8 |
| [13] |
SKOUMAL M, CABOT P L, CENTELLAS F, et al. Mineralization of paracetamol by ozonation catalyzed with Fe2+, Cu2+ and UVA light[J]. Applied Catalysis B: Environmental, 2006, 66(3/4): 228. DOI:10.1016/j.apcatb.2006.03.016 |
| [14] |
YANG Liming, YU L E, RAY M B. Degradation of paracetamol in aqueous solutions by TiO2 photocatalysis[J]. Water Research, 2008, 42(13): 3480. DOI:10.1016/j.watres.2008.04.023 |
| [15] |
YANG Liming, YU L E, RAY M B. Photocatalytic oxidation of paracetamol: Dominant reactants, intermediates, and reaction mechanisms[J]. Environmental Science & Technology, 2009, 43(2): 460. DOI:10.1021/es8020099 |
| [16] |
LI Tinggang, LIU Junxin, BAI Renbi, et al. Biodegradation of organonitriles by adapted activated sludge consortium with acetonitrile-degrading microorganisms[J]. Water Research, 2007, 41(15): 3465. DOI:10.1016/j.watres.2007.04.033 |
| [17] |
梁金松, 柏耀辉, 胡承志, 等. 锰生物氧化的研究进展及在水处理中的应用[J]. 应用与环境生物学报, 2013, 19(1): 11. LIANG Jinsong, BAI Yaohui, HU Chengzhi, et al. Research progress of biogenic manganese oxides and application potential in water treatment process[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(1): 11. DOI:10.3724/SP.J.1145.2013.00011 |
| [18] |
DUCKWORTH O W, BARGAR J R, SPOSITO G. Sorption of ferric iron from ferrioxamine B to synthetic and biogenic layer type manganese oxides[J]. Geochimica et Cosmochimica Acta, 2008, 72(14): 3371. DOI:10.1016/j.gca.2008.04.026 |
| [19] |
菅之舆, 常洋洋, 王立新, 等. 化学预氧化耦合生物锰氧化对水中有机物的去除[J]. 环境科学, 2018, 39(3): 1188. JIAN Zhiyu, CHANG Yangyang, WANG Lixin, et al. Removal of organic matter from water by chemical preoxidation coupled with biological manganese oxidation[J]. Environmental Sciences, 2018, 39(3): 1188. DOI:10.13227/j.hjkx.201707103 |
| [20] |
曹飞, 袁守军, 张梦涛, 等. 臭氧氧化水溶液中对乙酰氨基酚的机制研究[J]. 环境科学, 2014, 35(11): 4185. CAO Fei, YUAN Shoujun, ZHANG Mengtao, et al. Impact factors and degradation mechanism for the ozonation of acetaminophen in aqueous solution[J]. Environmental Sciences, 2014, 35(11): 4185. DOI:10.13227/j.hjkx.2014.11.020 |
| [21] |
苏键镁. 细菌氧化锰的作用机理及生物锰氧化物的特性研究[D]. 武汉: 华中农业大学, 2015 SU Jianmei. Studies on the mechanism of bacterial Mn(Ⅱ) oxidation and characteristics of biological manganese oxides[D]. Wuhan: Huazhong Agricultural University, 2015 |
| [22] |
TEBO B M, BARGAR J R, CLEMENT B G, et al. Biogenic manganese oxides: Properties and mechanisms of formation[J]. Annual Review of Earth and Planetary Sciences, 2004, 32: 287. DOI:10.1146/annurev.earth.32.101802.120213 |
| [23] |
FORRZE I, CARBALLA M, FINK G, et al. Biogenic metals for the oxidative and reductive removal of pharmaceuticals, biocides and iodinated contrast media in a polishing membrane bioreactor[J]. Water Research, 2011, 45(4): 1763. DOI:10.1016/j.watres.2010.11.031 |
| [24] |
SABIROVA J S, CLOETENS L F F, VANHAECKE L, et al. Manganese-oxidizing bacteria mediate the degradation of 17α-ethinylestradiol[J]. Microbial Biotechnology, 2008, 1(6): 507. DOI:10.1111/j.1751-7915.2008.00051.x |
| [25] |
SANTOS A, YUSTOS P, QUINTANILLA A, et al. Route of the catalytic oxidation of phenol in aqueous phase[J]. Applied Catalysis B: Environmental, 2002, 39(2): 97. DOI:10.1016/S0926-3373(02)00087-5 |
 2021, Vol. 53
2021, Vol. 53


