2. 哈尔滨工业大学 环境学院,哈尔滨 150090
2. School of Environment, Harbin Institute of Technology, Harbin 150090, China
磺胺类抗生素和喹诺酮类抗生素近年来被广泛使用,尤其是甲氧苄啶(TMP)和恩诺沙星(EFX),已被频繁报道检出于水体、土壤和农作物中[1]。在水环境中,即使抗生素的浓度很低,仍然可能会破坏本土微生物群体,促进耐药菌或病原体的生长,甚至可能导致人类畸形、诱发癌症等恶性影响发生[2-4]。生物法[5]由于成本低以及实用性强等优势成为去除水中抗生素的常用方法,但抗生素的去除主要是依靠活性污泥的吸附作用,后续的泥水混合液还需要进一步降解处理。化学氧化法基于氧化剂的直接氧化作用可以有效降解水中的抗生素,常用的氧化剂有次氯酸[6]、高锰酸钾[7]和高铁酸盐[8]等。这些氧化剂在其工艺的最优条件下都能够氧化去除甲氧苄啶和恩诺沙星,但是存在氧化剂利用率低、反应时间长等问题。
紫外辐射(UV)是一种新型高效、清洁的杀菌工艺,其与过氧化氢(H2O2)耦合使用可以产生具有强氧化能力的羟基自由基(HO·),将有机污染物氧化成H2O和CO2[9],UV/H2O2可以有效降解水中的TMP[10]。而过氧二硫酸盐(PDS)和过氧单硫酸盐(PMS)与H2O2结构相似,都具有O—O键[11-12]。在紫外辐射条件下,PDS和PMS发生O—O键断裂产生HO·和/或硫酸根自由基(SO4-·),而SO4-·也是一种强氧化性自由基。故而,UV/H2O2和UV/PDS常被作为HO·和SO4-·的典型工艺来研究基于HO·和SO4-·的高级氧化工艺的除污染性能。肖子捷等[13]对比研究了UV/PDS和UV/H2O2降解TMP的效果,发现UV/PDS对TMP的去除效果略优于UV/H2O2。而关于UV辐射和UV/过氧化物工艺对EFX降解的对比研究并不多。在UV/过氧化物去除药物的对比研究中,以喹诺酮类抗生素诺氟沙星(NOR)为目标污染物时,UV/PDS对NOR的降解效率高于UV/PMS[14]。类似地,对吡虫啉降解的对比研究中也发现UV/PDS的降解效率高于UV/PMS [15]。对于四环素类抗生素四环素(TET)的去除,UV/PMS的降解效率却高于UV/PDS[16]。在对磺胺类抗生素磺胺嘧啶(SDZ)、磺胺甲氧基哒嗪(SMP)和磺胺二甲氧基嘧啶(SDM)的降解研究中发现,UV/PDS对SDZ和SMP的降解效果好于UV/H2O2,而在去除SDM时,UV/H2O2的降解效率更高[17]。同时,Shad等[18]也对SDM的去除进行对比研究,结果表明,UV/PMS比UV/H2O2的降解效果好。
综上,对于不同的目标污染物或者在不同的反应条件下,UV/H2O2、UV/PMS和UV/PDS 3种氧化工艺的除污染效能对比顺序可能也不尽相同。基于此,以磺胺类抗生素甲氧苄啶(TMP)和喹诺酮类抗菌药物恩诺沙星(EFX)为目标物,研究单独紫外、紫外/过氧单硫酸盐(UV/PMS)、紫外/过氧二硫酸盐(UV/PDS)和紫外/过氧化氢(UV/H2O2)的除污染效率与降解速率随pH的变化规律; 其次,计算在酸性(pH 3.0)、中性(pH 7.0)和碱性(pH 11.0)条件下TMP和EFX的光分解量子产率; 最后,对比分析了UV/PMS、UV/PDS和UV/H2O2在自来水和地表水背景条件下对混合污染物中TMP和EFX的降解动力学。为应用UV和UV/过氧化物工艺降解水体中的磺胺类抗生素和喹诺酮类抗菌药物提供理论参考。
1 实验 1.1 试剂与材料过氧单硫酸钾(PMS)、过氧二硫酸钾(PDS)、磷酸氢二钠和磷酸二氢钠均为ACS试剂级,购自西格玛奥德里奇(上海)贸易有限公司。过氧化氢溶液(质量分数35%)购自阿法埃莎公司,液相色谱纯磷酸和甲醇分别购自天津迪马科技有限公司和赛默飞世尔科技公司,甲氧苄啶(TMP,98%)和恩诺沙星(EFX,98+%)购自北京伊诺凯有限公司。其他试剂均为分析纯,购自上海国药集团化学试剂有限公司。所有溶液均用Milli-QBiocel水系统生产的18.2 MΩ·cm Milli-Q水配制。自来水水体采自哈尔滨市居民供水管网。地表水水体采自哈尔滨市区内的松花江流段。
1.2 实验方法所有的光化学实验在圆柱形硼硅酸盐玻璃容器中进行,反应容器体积为0.55 L,光程为2.63 cm。低压汞灯(Heraeus,GPH135t5l/4,6 W,λ=254 nm)的入射辐射强度(I0)为0.905 J/s(1.92×10-6 Einstein/s) [19]。纯水背景实验中,通过投加一定量的HClO4、磷酸氢二钠/磷酸二氢钠缓冲液、KOH调节加入氧化剂之后的反应液至pH(3.0±0.1)、pH(7.0±0.1)和pH(11.0±0.1)(后分别表达为pH 3.0、pH 7.0和pH 11.0)。开始实验前,将目标物和氧化剂依次加入超纯水或实际水体中,混合均匀。将上述反应液放置到反应装置内,取零号样,即刻开始计时。在预设的反应时间节点取样,用过量的盐酸羟胺和甲醇终止反应。反应温度为(25±1) ℃,所有实验均重复两次以上。图中的误差线代表实验数据的标准差。假一级速率常数基于污染物降解率≤90%的实验数据进行拟合所得。
1.3 分析方法BA、TMP和EFX的浓度采用液相色谱(Waters Acquity UPLC H-Class)测定。色谱柱型号为Waters Acquity UPLC®BEH C18 column (2.1 mm×100 mm,1.7 μm颗粒),PDA检测器检测波长依次为226、270和270 nm,流动相采用乙腈和0.1%的甲酸水溶液,两者体积比为20∶ 80,流动速率为0.1 mL/min,柱温为25 ℃,进样体积为10 μL。溶液的pH使用上海雷磁精密酸度计(PHS-3C)pH计测定,溶液的温度使用水银温度计测量。PMS、PDS和H2O2的浓度分别采用酸性碘量法[20]、NaHCO3缓冲碘量法[21]和邻苯二甲酸氢钾缓冲碘量法[22]测定。
2 结果与讨论 2.1 TMP和EFX的紫外光分解速率与量子产率图 1为单独紫外光辐射下,TMP和EFX在酸性(pH 3.0)、中性(pH 7.0)和碱性(pH 11.0)条件下的降解规律。由图 1(a)可知,在pH 3.0条件下,反应10 min时,单独紫外光辐射对TMP的降解率为6%;当反应时间为30 min时,TMP的降解率达25.9%。随着pH的增加,TMP的降解效率呈现增加的趋势,当pH增加到11.0时,单独紫外辐射30 min,TMP的降解率达33.7%。由图 1(b)可知,当以EFX为目标污染物,在pH 3.0、反应10 min时,紫外辐射对EFX的降解率为20.9%。当pH增加至7.0和11.0时,EFX的降解效率显著增加,在反应5 min时,EFX的降解率分别达100%和94.3%。TMP和EFX的降解符合假一级反应动力学,通过式(1)拟合TMP和EFX的浓度随时间的变化曲线,可以得出TMP和EFX光分解的假一级速率常数(k0),见表 1。在pH 3.0、7.0和11.0条件下,TMP光分解的k0分别为0.000 1、0.000 1和0.000 2 s-1; EFX光分解的k0分别为0.000 6、0.008 2和0.010 5 s-1。
| $ \ln \left(c / c_0\right)=-k_0 t $ | (1) |

|
c(TMP)=2 μmol/L, c(EFX)=2 μmol/L。 图 1 单独紫外辐射对TMP和EFX的降解规律 Fig. 1 Degradation efficiencies of TMP and EFX by UV |
| 表 1 不同pH条件下TMP和EFX光分解的k0、ε和ϕ Tab. 1 Values of k0, ε, and ϕ of TMP and EFX photodegradation under different pH |
式中:c0为初始浓度, mol/L; c为剩余浓度, mol/L; k0为假一级速率常数, s-1; t为反应时间, s。
污染物直接光分解速率的计算公式如式(2)所示[23-24]。当溶液的吸光度A较小时,式(2)可以简化为式(3)。此时,污染物的直接光分解符合假一级动力学,如式(4)所示。根据表 1中TMP和EFX光分解的k0和ε,可以计算出相应条件下的表观量子产率(ϕ),见表 1。TMP和EFX在pH 3.0、7.0和11.0条件下直接光分解的ϕ分别为0.001 0、0.001 3、0.003 6和0.005 3、0.051 1、0.064 5。TMP和EFX的ϕ随pH发生显著变化, 这可能是由于TMP和EFX在溶液中存在的型体随pH的变化发生了转变,而分子的质子化或者去质子化会影响其存在型体的共轭程度,从而影响电子跃迁的能级大小和量子产率。
| $ \begin{gathered} -\frac{\mathrm{d} c}{\mathrm{~d} t}=\phi \varepsilon c L \times \frac{I_0}{b} \times \frac{1-10^{-A}}{A \times V} \end{gathered} $ | (2) |
| $ -\frac{\mathrm{d} c}{\mathrm{~d} t}=\frac{2.3 \phi \varepsilon c L}{V} \times \frac{I_0}{b} $ | (3) |
| $ \ln \left(c / c_0\right)=-\frac{2.3 \phi I_0 \varepsilon L}{b \times V} t=-k_0 t $ | (4) |
式中:A为溶液的吸光度值; ε为摩尔吸光系数, L/(mol · cm); c为吸光物质的浓度, mol/L; I0为入射辐射强度, J/s; ϕ为量子产率; b为λ=254 nm处的能量换算系数,4.714 1×105 J/Einstein。
TMP的酸解离常数分别是pKa, 1=3.2和pKa, 2= 7.1[13],EFX的酸解离常数为pKa, 1=6.2和pKa, 2=7.9[25]。根据TMP和EFX的酸解离平衡常数,计算出TMP和EFX在不同pH条件下的型体分布系数,如图 2。可以看出,当pH < 10.0时,随着pH的降低,TMP发生质子化分别形成一价阳离子和二价阳离子形态。在pH 3.0时,TMP主要以一价阳离子和二价阳离子的型体存在,在pH 7.0时,TMP主要以一价阳离子和中性分子型体存在,在pH 11.0时,TMP以中性分子的型体存在。EFX在pH 3.0和pH 11.0条件下,分别发生质子化与去质子化,主要以其一价阳离子和负一价阴离子型体存在,而在pH 7.0时,大部分以两性离子型体存在。
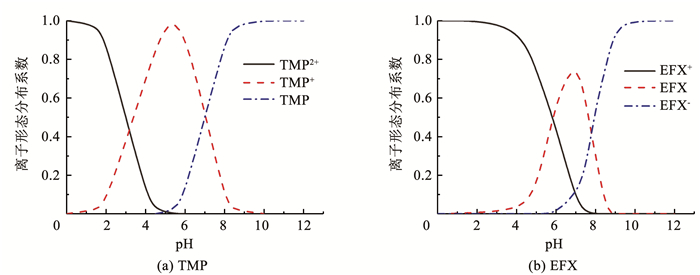
|
图 2 TMP和EFX的型体分布随pH的变化 Fig. 2 Species distribution of TMP and EFX under different pH |
由表 1可以看出,TMP的ε随着pH的增加而降低,根据图 2(a)所示的TMP在不同pH条件下的型体分布规律,可以计算出TMP的二价阳离子型体、一价阳离子型体和分子型体的ε分别为5 074、4 598和2 635 L/(mol·cm),依次降低,但其在λ=254 nm的直接光分解的ϕ依次增加(表 1),这与Baeza和Knappe[10]报道的TMP在λ=254 nm处的ε和ϕ随pH的变化规律一致。虽然本研究与文献[10]中研究的pH条件不同,但是在中性pH条件下本研究计算得到的ϕ(ϕ=0.001 3,pH 7.0)与文献[10]报道的数值(ϕ=0.001 2,pH 7.9)接近。基于式(4)和图 2(a)可以进一步计算出TMP的二价阳离子型体、一价阳离子型体和分子型体的ϕ依次为0.001 4、0.000 2和0.003 6。EFX的ε随着pH的增加而增加(表 1)。基于图 2(b)所示的EFX的型体分布随pH的变化,可以计算出EFX的阳离子型体、两性离子型体、阴离子型体的ε分别为5 343、7 938和7 709 L/(mol·cm),依次增加。进一步计算3种型体的ϕ为0.005 3、0.054 4和0.064 5,也依次增加。且EFX的两性离子型体、阴离子型体的ϕ显著大于阳离子型体,相差一个数量级,这一变化趋势与Wammer等[26]报道的在模拟太阳光(λ=296~450 nm)条件下EFX的ϕ随pH的变化规律相似,EFX的两性离子型体和阴离子型体的ϕ(ϕ=0.051 0和0.022 0)远远大于阳离子型体(ϕ=0.001 5)。
2.2 紫外/过氧化物体系对TMP和EFX的降解速率图 3为紫外/过氧化物体系中,PMS、PDS和H2O2的初始浓度均为50 μmol/L时,TMP和EFX在酸性(pH 3.0)、中性(pH 7.0)和碱性(pH 11.0)条件下的降解规律。k0通过拟合TMP和EFX在不同紫外/过氧化物体系中的降解数据得出,见表 2。由图 3(a)可知,以TMP为目标物时,在pH 3.0条件下,UV/PMS、UV/PDS和UV/H2O2反应体系在2 min内的降解率分别达65.3%、100%和72%,TMP降解的k0依次为0.009 6、0.025 6和0.012 4 s-1; 在pH 7.0条件下,3种氧化体系在2 min时的降解率分别达42.4%、82.7%和74.6%,k0依次为0.005 6、0.015 5和0.010 7 s-1; 在pH 11.0条件下,反应1 min时,降解率分别达95.1%、47.7%和41.9%,k0依次为0.050 6、0.013 0和0.009 6 s-1。由图 3(b)可知,以EFX为目标物时,在pH 3.0条件下,UV/PMS、UV/PDS和UV/H2O2反应体系在5 min内的降解率分别达84.9%、100%和83.8%,k0依次为0.006 5、0.018 9和0.005 6 s-1; 在pH 7.0条件下反应3 min时,降解率分别达89.1%、100%和87.2%,k0依次为0.013 2、0.027 6和0.010 0 s-1; 在pH 11.0条件下,反应2 min时,降解率分别达100%、88.7%和82.0%,k0依次为0.032 4、0.018 9和0.011 2 s-1。

|
c(TMP)=2 μmol/L, c(EFX)=2 μmol/L, c(PMS)=50 μmol/L, c(PDS)=50 μmol/L, c(H2O2)=50 μmol/L。 图 3 不同pH条件下UV/PMS、UV/PDS和UV/H2O2对TMP和EFX的降解效率 Fig. 3 Degradation efficiencies of TMP and EFX by UV/PMS, UV/PDS, and UV/ H2O2 under different pH |
| 表 2 不同pH条件下紫外/过氧化物对TMP和EFX降解的k0 Tab. 2 k0 of TMP and EFX degradation in UV/peroxide processes under different pH |
实验结果表明,以TMP为目标污染物时,在pH为3.0和7.0的条件下,3种氧化体系的除污染效率按照UV/PMS、UV/H2O2、UV/PDS的顺序依次升高,但在pH 11.0时,TMP的降解效率按UV/H2O2、UV/PDS、UV/PMS的顺序依次增加。以EFX为目标污染物,在pH为3.0和7.0时,各体系的除污染效果按照UV/H2O2、UV/PMS、UV/PDS的顺序依次增强。而在pH 11.0时,UV/PMS对EFX降解速率最快,这与TMP的降解规律极为相似。推测在不同的pH条件下,3种紫外/过氧化物体系对TMP和EFX降解速率的差别可能主要取决于体系中活性自由基(HO·和/或SO4-·)的产生速率。PMS的一价阴离子HSO5-和二价阴离子SO52-的ε分别为13.8和149.5 L/(mol·cm),其在λ=254 nm光解产生HO·/SO4-·的量子产率为ϕ=0.52[27]。PDS在λ=254 nm处的ε和光解产生SO4-·的量子产率ϕ分别为20.07 L/(mol·cm)和1.4[28]。H2O2及阴离子HO2-的ε分别为19.6和229 L/(mol·cm) [29],H2O2在λ=254 nm处光解产生HO·的量子产率为ϕ=1.0[24]。根据式(2)可以看出,在pH为3.0和7.0时,UV/PDS体系中的活性自由基产生速率最大,UV/H2O2体系次之,UV/PMS体系最小。而在pH 11.0时,PMS(pKa=9.4)主要以SO52-的形式存在,与中性pH条件下相比,PMS的ε增加,导致HO·和SO4-·的总产生速率显著增加。由此可以看出,紫外/过氧化物体系对TMP和EFX降解的k0对比结果与3种体系中的HO·和/或SO4-·总产生速率基本一致。
以TMP为目标污染物时,UV/PDS和UV/H2O2体系的k0随着pH的增加呈现下降的趋势,而以EFX为目标污染物时,UV/PDS和UV/H2O2体系在pH 7.0和11.0条件下的k0显著大于pH 3.0(表 2)。这可能是由于TMP在pH 3.0、7.0和11.0条件下单独紫外辐射的直接光分解速率均比较慢,对其在UV/过氧化物体系中的分解速率贡献不大。UV/过氧化物体系中TMP的降解主要取决于与HO· 和/或SO4-·的反应。而随着pH的增加,UV/PDS体系中的SO4-·会转化为HO·,而HO·与PDS的二级反应速率常数要大于SO4-·[28]。根据自由基的分配比(RPR)[23],SO4-·转化为HO·会导致自由基的有效利用率降低,从而降低了TMP的去除速率。而以EFX为目标污染物时,在pH7.0和11.0时,EFX的直接光分解速率大,对其在UV/过氧化物体系中的分解速率贡献显著。从而EFX的直接光解速率随pH的变化规律,主导了UV/PDS和UV/H2O2体系中EFX的降解速率随pH的变化。
2.3 实际水体背景对紫外/过氧化物体系降解TMP和EFX速率的影响 2.3.1 自来水水体背景的影响图 4为自来水水体背景条件下,紫外/过氧化物体系对混合污染物溶液中TMP、EFX和BA的降解规律。自来水的水质指标见表 3。由图 4可知,在反应30 min时,对于自身不发生光分解的BA,UV/PMS、UV/PDS和UV/H2O2对其的降解率分别为34.1%、36.3%和45.7%。3种氧化体系对TMP的降解率分别为>99%、>99%和74.4%。3种氧化体系对EFX的降解速率明显比TMP快,在反应2 min时,UV/PMS、UV/PDS和UV/H2O2对EFX的降解率分别为89.6%、100%和52.5%。采用假一级反应动力学模型拟合各体系中TMP、EFX和BA的降解,拟合所得k0见表 4。UV/PMS、UV/PDS和UV/H2O2对参考目标物BA降解的k0依次为0.000 3、0.000 3和0.000 4 s-1,TMP降解的k0依次为0.001 4、0.001 3和0.000 8 s-1,EFX降解的k0依次为0.021 3、0.047 4和0.004 8 s-1。
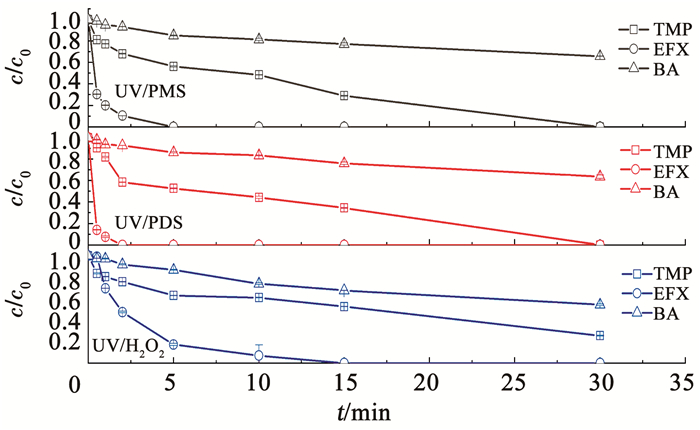
|
c(TMP)=2 μmol/L, c(EFX)=2 μmol/L, c(BA)=3.5 μmol/L, c(PMS)= 200 μmol/L, c(PDS)=200 μmol/L, c(H2O2)= 200 μmol/L。 图 4 自来水背景条件下UV/PMS、UV/PDS和UV/H2O2对BA、TMP和EFX混合污染物的降解 Fig. 4 Degradation of BA, TMP, and EFX by UV/PMS, UV/PDS, and UV/H2O2 in tap water |
| 表 3 自来水水质参数 Tab. 3 Water quality index of tap water |
| 表 4 自来水水体背景下不同紫外/过氧化物体系中TMP和EFX降解的k0 Tab. 4 k0 of TMP and EFX degradation in UV/peroxide processes in tap water |
实验结果表明,自来水水体背景下3种氧化体系对EFX的降解效果按照UV/H2O2、UV/PMS、UV/PDS的顺序依次增强,与纯水背景条件下结论一致。对于TMP的降解,UV/PMS和UV/PDS的降解速率相近,大于UV/H2O2。可以看出,自来水水体背景成分对UV/PMS除污染效率的抑制程度明显小于UV/H2O2和UV/PDS。这可能是由于PMS具有不对称的—O—O—键结构,更容易被自来水体中的背景成分活化(如苯醌类有机物和氯离子等)产生HO·、SO4-·、O21或HClO,加速TMP的降解[30-31]。而UV/H2O2对TMP、EFX和BA降解的k0均显著小于其他两种体系,与纯水背景条件下相比,自来水水体背景成分对UV/H2O2体系的除污染效果抑制作用显著。UV/H2O2体系的活性物种主要是HO·,说明自来水背景成分可能对HO·的捕获作用更强。
2.3.2 地表水水体背景的影响图 5为地表水水体背景条件下,紫外/过氧化物体系对混合污染物溶液中TMP、EFX和BA降解规律。地表水水质指标见表 5。由图 5可知,反应30 min时,UV/PMS、UV/PDS和UV/H2O2对BA的降解率分别为29.4%、24.4%和46.7%,对TMP的降解率分别为90.0%、>99%和99%。反应2 min时,UV/PMS、UV/PDS和UV/H2O2对EFX的降解率分别为84.3%、91.4%和48.9%。地表水水体背景条件下,TMP、EFX和BA的降解k0见表 6。UV/PMS、UV/PDS和UV/H2O2对BA降解的k0分别为0.000 2、0.000 2和0.000 4 s-1,TMP降解的k0依次为0.001 4、0.002 0和0.002 4 s-1,EFX降解的k0依次为0.019 4、0.023 1和0.003 2 s-1。

|
c(TMP)=2 μmol/L, c(EFX)=2 μmol/L, c(BA)=3.5 μmol/L, c(PMS) =200 μmol/L, c(PDS)=200 μmol/L, c(H2O2)= 200 μmol/L。 图 5 地表水背景条件下UV/PMS、UV/PDS和UV/H2O2对BA、TMP和EFX混合污染物的降解 Fig. 5 Degradation of BA, TMP, and EFX by UV/PMS, UV/PDS, and UV/H2O2 in surface water |
| 表 5 地表水水质参数 Tab. 5 Water quality index of surface water |
| 表 6 地表水体背景下不同紫外/过氧化物体系中TMP和EFX降解的k0 Tab. 6 k0 of TMP and EFX degradation in UV/peroxide processes in surface water |
实验结果表明,地表水背景条件下,UV/PMS、UV/PDS和UV/H2O2对TMP降解效率相差不大,UV/H2O2去除最佳; 而UV/PMS和UV/PDS对EFX的降解速率明显大于UV/H2O2,UV/PDS降解速率最快。与自来水水体背景相比,地表水水体背景下UV/PMS、UV/PDS和UV/H2O2对BA降解的k0均有所降低。而BA自身不发生光分解,这说明地表水条件下各体系活性自由基的稳态浓度要低于自来水水体背景条件。地表水的水质指标UV254、TOC、碱度(HCO3-)、NO3-和Cl-质量浓度等显著大于自来水的相应指标,UV254反应了地表水成分对紫外光的屏蔽作用。根据式(2),地表水由于光屏蔽作用会导致各氧化体系中自由基的产生速率降低约13%。NO3-在紫外辐射下能够产生HO·[23],促进污染物的降解。然而,在λ=254 nm处NO3-的ε和ϕ分别为3.6 L/(mol·cm)和0.052 6[23],经计算本文中地表水条件下NO3-光解产生HO·的速率相对UV/过氧化物体系中HO·和/或SO4-·的产生速率可以忽略。Cl-的存在也会使得HO·和SO4-·部分转化为具有选择性的Cl2-·[23, 28],可能导致污染物去除效率的降低。而有机物(TOC)和HCO3-是天然水体中主要的自由基捕获剂[25],有机物和HCO3-浓度的增加,将明显降低污染物的去除速率。在地表水和自来水背景条件下,混合污染物中TMP降解的k0远远小于EFX,这可能是由于TMP与自由基的反应活性小于EFX。
2.3.3 实际水体背景下过氧化物的分解速率自来水和地表水背景条件下的过氧化物分解规律如图 6所示。在反应30 min时,自来水中的PMS、PDS和H2O2的消耗率分别为36%、33%和11%,地表水中的各过氧化物的消耗率分别为31%、26%和15%。

|
c(TMP)=2 μmol/L, c(EFX)=2 μmol/L, c(BA)=3.5 μmol/L, c(PMS)=200 μmol/L, c(PDS)=200 μmol/L, c(H2O2)=200 μmol/L。 图 6 实际水体背景条件下UV/PMS、UV/PDS和UV/H2O2体系中各过氧化物浓度变化 Fig. 6 Variation of peroxide concentrations with time in UV/PMS, UV/PDS, and UV/H2O2 in real water |
地表水中的各过氧化物均比自来水中分解慢,这可能是由于地表水的UV254高于自来水,地表水组分对紫外光的屏蔽作用降低了过氧化物的光分解速率。在两种实际水体背景下,PMS的消耗最快,PDS次之,H2O2最慢。据报道,PDS在λ=254 nm处的ε和光分解的ϕ分别为20.07 L/(mol·cm)和0.7[28]。H2O2的ε和光分解的ϕ分别为19.6 L/(mol·cm)[29]和0.5[24]。PDS的ε和ϕ均大于H2O2,导致PDS的光分解速率大于H2O2。同时,在污染物的降解过程中可能会形成O2-·,而O2-·的结合也会生成H2O2[24],导致H2O2的消耗速率减慢。HSO5-在λ=254 nm处的ε和ϕ分别为13.8 L/(mol·cm)和0.52[27]。理论上,PMS的光分解速率应该低于PDS和H2O2,然而PMS具有不对称性结构,更容易被活化,且能够与Cl-[31]、HCO3-[32]和醌类有机物[33]等发生反应,继而加速其分解。
3 结论1) 单独紫外辐射时,在pH 3.0、7.0和11.0条件下,TMP和EFX光分解的k0分别为0.000 1、0.000 1、0.000 2 s-1和0.000 6、0.008 2、0.010 5 s-1。TMP和EFX光分解的k0随pH增加而增加,并且在相同的pH条件下,EFX的光分解速率明显比TMP快。在pH 3.0、7.0和11.0条件下,TMP和EFX光分解的ϕ(λ=254 nm)分别为0.001 0、0.001 3、0.003 6和0.005 3、0.051 1、0.064 5。
2) 超纯水背景条件下,在pH 3.0和7.0时,UV/PDS对TMP和EFX降解的k0最大,而在pH 11.0时,UV/PMS体系的k0最大。以TMP为目标污染物时,UV/PDS和UV/H2O2体系的k0随着pH的增加呈现下降的趋势; 而以EFX为目标污染物时,UV/PDS和UV/H2O2体系在pH 7.0和11.0条件下的k0显著大于pH 3.0时。这主要是由于EFX的直接光分解速率远大于TMP,EFX的光分解速率对其在UV/过氧化物体系中的分解速率贡献显著,从而EFX的直接光解速率随pH的变化规律,主导了UV/PDS和UV/H2O2体系中EFX的降解速率随pH的变化。
3) 自来水背景条件下,对于混合污染物溶液中TMP的降解,UV/PMS和UV/PDS的降解速率相近,大于UV/H2O2; 对于EFX的降解,UV/PDS效果最好。地表水背景条件下,UV/PMS、UV/PDS和UV/H2O2对TMP降解效率相差不大,UV/H2O2去除最佳; 而UV/PMS和UV/PDS对EFX的降解速率明显大于UV/H2O2,UV/PDS降解速率最快。
| [1] |
高俊红. 抗生素磺胺噻唑和恩诺沙星在水环境中的吸附和光解行为研究[D]. 兰州: 兰州大学, 2016 GAO Junhong. Adsorption and photodegradation of sulfathiazole and enrofloxacin in aquatic environment[D]. Lanzhou: Lanzhou University, 2016 |
| [2] |
CHEN Qiuwen, DONG Jianwei, ZHANG Tao, et al. A method to study antibiotic emission and fate for data-scarce rural catchments[J]. Environment International, 2019, 127: 514. DOI:10.1016/j.envint.2019.04.014 |
| [3] |
INYINBOR A A, BELLO O S, FADIJI A E, et al. Threats from antibiotics: a serious environmental concern[J]. Journal of Environmental Chemical Engineering, 2018, 6(1): 784. DOI:10.1016/j.jece.2017.12.056 |
| [4] |
INYINBOR A A, TSOPMO A, UDENIGWE C C. Antibiotics threats on vegetables and the perils of low income nations practices[J]. Sustainable Chemistry and Pharmacy, 2021, 21: 100448. DOI:10.1016/j.scp.2021.100448 |
| [5] |
NIELSEN L, BANDOSZ T J. Analysis of sulfamethoxazole and trimethoprim adsorption on sewage sludge and fish waste derived adsorbents[J]. Microporous and Mesoporous Materials, 2016, 220: 58. DOI:10.1016/j.micromeso.2015.08.025 |
| [6] |
DODD M C, HUANG C H. Aqueous chlorination of the antibacterial agent trimethoprim: reaction kinetics and pathways[J]. Water Research, 2007, 41(3): 647. DOI:10.1016/j.watres.2006.10.029 |
| [7] |
HU Lanhua, MARTIN H M, STRATHMANN T J. Oxidation kinetics of antibiotics during water treatment with potassium permanganate[J]. Environmental Science & Technology, 2010, 44(16): 6416. DOI:10.1021/es101331j |
| [8] |
ANQUANDAH G A K, SHARMA V K, KNIGHT D A, et al. Oxidation of trimethoprim by ferrate (VI): kinetics, products, and antibacterial activity[J]. Environmental Science & Technology, 2011, 45(24): 10575. DOI:10.1021/es202237g |
| [9] |
王炜亮, 王玉番, 卢少勇, 等. US/UV-Fenton体系处理高浓度罗丹明B特性研究[J]. 中国环境科学, 2016, 36(8): 2329. WANG Weiliang, WANG Yufan, LU Shaoyong, et al. Characteristic studies on treatment of high concentration rhodamine B with US/UV-Fenton system[J]. China Environmental Science, 2016, 36(8): 2329. |
| [10] |
BAEZA C, KNAPPE D R U. Transformation kinetics of biochemically active compounds in low-pressure UV photolysis and UV/H2O2 advanced oxidation processes[J]. Water Research, 2011, 45(15): 4535. DOI:10.1016/j.watres.2011.05.039 |
| [11] |
CHEN Juliang, BRUELL C J, MARLEY C M, et al. Thermally activated persulfate oxidation of trichloroethylene (TCE) and 1, 1, 1-trichloroethane (TCA) in aqueous systems and soil slurries[J]. Soil Sediment Contamination, 2003, 12(2): 210. DOI:10.1080/1058833031878816 |
| [12] |
BETTERTON E A, HOFFIMANN M R. Kinetics and mechanism of the oxidation of aqueous hydrogen sulfide by peroxymonosulfate[J]. Environmental Science and Technology, 1990, 24(12): 1822. DOI:10.1021/es00082a005 |
| [13] |
肖子捷, 刘祖文, 高乃云, 等. UV/PS和UV/H2O2工艺对水中甲氧苄氨嘧啶降解效果的对比研究[J]. 四川环境, 2015, 34(5): 2. XIAO Zijie, LIU Zuwen, GAO Naiyun, et al. Comparison study on trimethoprim degradation efficiency by UV/H2O2 and UV/PS processes in the water[J]. Sichuan Environment, 2015, 34(5): 2. |
| [14] |
温学. 紫外/过硫酸盐降解水中抗生素的研究[D]. 吉林: 吉林建筑大学, 2018 WEN Xue. Study on degradation of antibiotics in water by UV/persulfate[D]. Jilin: Jilin Jianzhu University, 2018 |
| [15] |
WANG Qiongfang, RAO Pinhua, LI Guanghui, et al. Degradation of imidacloprid by UV-activated persulfate and peroxymonosulfate processes: kinetics, impact of key factors and degradation pathway[J]. Ecotoxicology and Environmental Safety, 2020, 187: 109779. DOI:10.1016/j.ecoenv.2019.109779 |
| [16] |
HU Jiamin, ZHANG Jing, WANG Qingguo, et al. Efficient degradation of tetracycline by ultraviolet-based activation of peroxymonosulfate and persulfate[J]. Water Science & Technology, 2019, 79(5): 911. DOI:10.2166/wst.2019.034 |
| [17] |
ZHANG Ruochun, YANG Yongkui, HUANG Chinghua, et al. Kinetics and modeling of sulfonamide antibiotic degradation in wastewater and human urine by UV/H2O2 and UV/PDS[J]. Water Research, 2016, 103: 283. DOI:10.1016/j.watres.2016.07.037 |
| [18] |
SHADA A, CHEN Jing, QUA Ruijuan, et al. Degradation of sulfadimethoxine in phosphate buffer solution by UV alone, UV/PMS and UV/H2O2: kinetics, degradation products, and reaction pathways[J]. Chemical Engineering Journal, 2020, 398: 125357. DOI:10.1016/j.cej.2020.125357 |
| [19] |
RAHN R O, STEFAN M I, BOLTON J R, et al. Quantum yield of the iodide-iodate chemical actinometer: dependence on wavelength and concentration[J]. Photochemistry and Photobiology, 2007, 78(2): 150. DOI:10.1562/0031-8655(2003)0780146QYOTIC2.0.CO2 |
| [20] |
BALL R E, EDWARDS J O, HAGGETT M L, et al. A kinetic and isotopic study of the decomposition of monoperoxyphthalic acid[J]. Journal of the American Chemical Society, 1967, 89(10): 2331. DOI:10.1021/ja00986a015 |
| [21] |
LIANG Chenju, HUANG C F, MOHANTY N, et al. A rapid spectrophotometric determination of persulfate anion in ISCO[J]. Chemosphere, 2008, 73(9): 1540. DOI:10.1016/j.chemosphere.2008.08.043 |
| [22] |
KLASSEN N, MARCHINGTON D, MCGOWAN H C E. H2O2 determination by the I3- method and by KMnO4 titration[J]. Analytical Chemistry, 1994, 66: 2921. DOI:10.1021/AC00090A020 |
| [23] |
GUAN Yinghong, MA Jun, LIU Dengke, et al. Insight into chloride effect on the UV/peroxymonosulfate process[J]. Chemical Engineering Journal, 2018, 352: 484. DOI:10.1016/j.cej.2018.07.027 |
| [24] |
CRITTENDEN J C, HU Shumin, HAND D W. A kinetic model for H2O2/UV process in a completely mixed batch reactor[J]. Water Research, 1999, 33(10): 2323. DOI:10.1016/S0043-1354(98)00448-5 |
| [25] |
相元泉. 基于紫外光的高级氧化降解水中恩诺沙星机理研究[D]. 上海: 上海海洋大学, 2021 XIANG Yuanquan. Study on the degradation mechanism of enofloxacin from water with UV based oxidation technology[D]. Shanghai: Shanghai Ocean University, 2021 |
| [26] |
WAMMER K H, KORTE A R, LUNDEEN R A, et al. Direct photochemistry of three fluoroquinolone antibacterials: norfloxacin, ofloxacin, and enrofloxacin[J]. Water Research, 2013, 47: 443. DOI:10.1016/j.watres.2012.10.025 |
| [27] |
GUAN Yinghong, MA Jun, LI Xuchun, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J]. Environmental Science & Technology, 2011, 45(21): 9308. DOI:10.1021/es2017363 |
| [28] |
ZHANG Weiqiu, ZHOU Shiqing, SUN Julong, et al. Impact of chloride ions on UV/H2O2 and UV/persulfate advanced oxidation processes[J]. Environmental Science & Technology, 2018, 52(13): 7380. DOI:10.1021/acs.est.8b01662 |
| [29] |
BAXENDALE J H, WILSON J A. The photolysis of hydrogen peroxide at high light intensities[J]. Transactions of the Faraday Society, 1957, 53: 347. DOI:10.1039/TF9575300344 |
| [30] |
GUAN Yinghong, CHEN Jin, CHEN Lijun, et al. Comparison of UV/H2O2, UV/PMS, and UV/PDS in destruction of different reactivity compounds and formation of bromate and chlorate[J]. Frontiers in Chemistry, 2020, 8: 581198. DOI:10.3389/fchem.2020.581198 |
| [31] |
ZHOU Yang, JIANG Jin, GAO Yuan, et al. Oxidation of steroid estrogens by peroxymonosulfate (PMS) and effect of bromide and chloride ions: kinetics, products, and modeling[J]. Water Research, 2018, 138: 56. DOI:10.1016/j.watres.2018.03.045 |
| [32] |
YANG Shiying, WANG Ping, YANG Xin, et al. Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants: persulfate, peroxymonosulfate and hydrogen peroxide[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 552. DOI:10.1016/j.jhazmat.2010.03.039 |
| [33] |
ZHOU Yang, JIANG Jin, GAO Yuan, et al. Activation of peroxymonosulfate by benzoquinone: a novel nonradical oxidation process[J]. Environmental Science & Technology, 2015, 49(21): 12941. DOI:10.1021/acs.est.5b03595 |
 2023, Vol. 55
2023, Vol. 55


