2. 中国电建集团华东勘测设计研究院, 杭州 311122
2. Power China Huadong Engineering Corporation, Hangzhou 311122, China
户内供水管道是配水管道系统的一部分[1-3]。由于直接面对用户,户内管道内的水力工况较城市管网更为复杂。小区住户的人口结构、用水习惯以及户内各种用水设施(如卫浴设施等)的差异都会综合反映在用户的不同用水模式上,对户内管网水质及生物膜的形成造成影响。Douterelo等[4]设计了循环反应器探究3种水力工况下建筑物内管道水及生物膜微生物群落结构的差异,发现不同的流量变化会导致管道内微生物群落结构的巨大差异。Liu等[5]检测了高使用频率和低使用频率龙头的出水,发现军团菌与铜绿假单胞菌在使用频率较低的龙头出水中检出率较高。Lautenschlager等[6]在一夜滞留和冲洗水龙头之后,从10个独立的家庭中抽取水,发现微生物浓度在滞留后的所有水样中增加了2.3倍、ATP浓度增加了2~18倍、异养平板计数(heterotrophic plate count,以下简称“HPC”)增加了4~58倍。
近年来,条件致病菌(opportunistic pathogens,以下简称“OPs”)由于其耐热、抗消毒剂、多重抗药性等特点成为饮用水相关介水传播疾病暴发的重要病原之一。铜绿假单胞菌对抗生素具有抗性,会引发军团病、庞蒂亚克热等疾病,加重感染患者的死亡风险[7]。铜绿假单胞菌在户内管道水和生物膜中广泛存在。在中国成都的一项调查中发现,生活饮用水存在铜绿假单胞菌污染,且二次系统中铜绿假单胞菌检出率显著高于管网水[8]。在中国南部的一项研究中检出点龙头水的铜绿假单胞菌拷贝数达11/mL。铜绿假单胞菌的生长与许多因素相关,如管材[9]、消毒剂[10]、水龙头[11]、水力工况[12],其中,水力工况被认为是影响生物膜中致病菌生长的重要因素。文献[13]建立了一个包括湍流、层流和滞留3种水力模型的管道系统模型,发现与层流相比,湍流管中生物膜含有较高的军团菌数,而滞留状态下管道生物膜中军团菌的数量最低。Wang等[14]用管道模拟系统研究了消毒剂、水力停留时间和管材对军团菌、分支杆菌、铜绿假单胞菌和两种阿米巴虫生长的影响。发现水力停留时间的增加会增加OPs和两虫的数量。由于户内管道的隐蔽性,很难对其生物膜进行批量采样,以往研究通常采用反应器或循环/半循环模拟系统[4, 15],但是模拟条件无法准确还原在现实环境中运行的实际户内管道细菌的群落特征[16]。并且,目前尚未有围绕户内管道典型水力工况对铜绿假单胞菌生长影响的研究。
以HZ市某小区已安装远传户表的1 100户用户2020全年时用水量数据为背景条件,平行设置高变化流量(HIG)、中等变化流量(MED)、低变化流量(LOW)、恒定流量(SS)和滞留168 h(RET)5种户内管道典型水力工况,运行3个月后收集33组生物膜样品和水样,开展实时荧光定量(real time qPCR,以下简称“qPCR”)和16S rRNA基因测序分析,对比不同水力工况对水样和膜样中微生物生长的影响。为户内供水管道典型水力工况对管道微生物群落结构及OPs生长的影响提供依据。
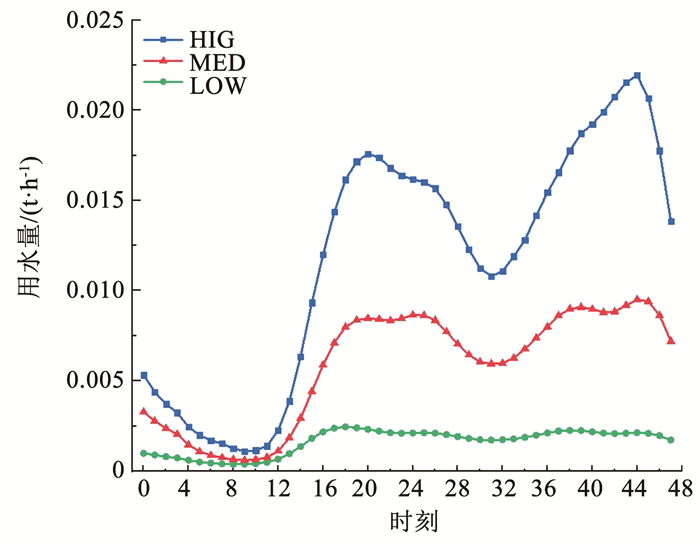
1 实验 1.1 户内供水管道模拟平台搭建选择中国东部某城市HZ一住宅小区内已安装远传户表的1 100户用户为研究对象,收集用户表 2020全年的用水量数据,其中,1—9月为半小时用水量数据,10—12月为时用水量数据。同时收集该小区室内给水系统设计资料,关注监测点管径和管材。调查结果显示,小区户内管道多采用PPR管,管径以DN25 (1寸管)为主。PPR管具有耐高温高压、耐腐蚀、使用寿命长、免维护等特点[17-18]。在工况设计上,先将用户用水量数据进行预处理,而后聚类得到各个季度的3种典型用水模式[19]。由于实验安排在1—3月进行,选择春季的高变化流量(HIG)、中等变化流量(MED)、低变化流量(LOW)3种水力工况作为户内管道模拟平台运行的工况(见图 1)。工况每日重复运行,持续3个月。
|
图 1 户内管道模拟平台运行工况 Fig. 1 Hydraulic condition of premise plumbing |
如图 2所示,模拟平台搭建于HZ市某高校的实验大厅内,该平台内布置5组并联管线,每组主体实验管线均由15段长0.2 m的管段串联而成,管径为DN25,管材为PPR管。流量变化通过电动小流量调节阀进行调节,由PLC系统远程控制阀门开度以实现流量连续变化,模拟户内管道典型水力工况。同时,平台还设置滞留168 h工况[20-22](RET)和恒定流量工况Q=0.003 4 t/h(SS)与户内管道3种典型的水力工况进行对比分析。滞留工况的两个间隔时间之间打开管线末端水龙头,新鲜水以3.8 L/min持续通过系统28 s,以模拟最不利龙头使用频率工况[23]。所有工况运行周期为3个月。模拟平台与实际管网相连,进水由实际户内管道接入,非循环流动,出水通过水槽直接排走。

|
图 2 户内管道模拟平台 Fig. 2 Simulation platform of premise plumbing |
在平台投入使用之前,用有效氯质量分数5%的次氯酸钠溶液稀释100倍后对装置进行消毒,以保证PPR管内壁的无菌状态。
1.2 培养过程水质指标检测实验过程中用水质分析仪每周测定水样中溶解氧、电导率、温度、浊度、pH、余氯。水中总有机碳(total organic carbon,TOC)的测定采用燃烧氧化-非分散红外吸收法,使用岛津5000TOC仪进行操作。可培养微生物细胞数的测定用R2A琼脂培养基对样品微生物悬浊液进行异养菌平板计数[24]。
1.3 水样和生物膜现场采集与预处理方法在采集生物膜样品前,直接从各管线末端小水龙头和装置进水处重复收集3次2 L水样。共收集了18个水样,并通过0.22 μm的MCE水系膜过滤。采集完水样后,关闭平台的进水阀,并缓慢排掉平台中的水,卸下管段并移至干净场所,用已灭菌的长柄棉签均匀刷取管道内壁直至管壁内无肉眼可见管垢,再将棉签头用灭菌剪刀剪下,转移至备好的装有30 mL无菌水的离心管中。共收集15个生物膜样品。将样品置于低温采样箱中并迅速转移至实验室4 ℃冰箱中。
为保证实验结果的准确性,在24 h内对生物膜样品进行预处理,预处理步骤按照Peng等[25]制定的方法进行。
用FastDNA SPIN kit for Soil(MP Biomedicals,美国)提取滤膜上微生物的基因组DNA,具体操作参照说明书进行。将提取后的DNA定容于50 μL无核酸酶溶液(DNase/Pyrogen-Free solution)中,最后保存于-20 ℃冰箱[26]。
1.4 ATP检测水样和膜样中的ATP使用碧云天增强型ATP检测试剂盒(Enhanced ATP Assay Kit)和M5全波段多功能酶标仪(Molecular Devices)进行测定,操作参照说明书进行。
1.5 细菌总数和活菌数测定细菌总数(total cell concentration,以下简称“TCC”)和活菌数采用FACSCaibur型流式细胞仪(FCM)(美国BD)和Live/Dead Baclight试剂盒测定。具体操作步骤如下:用玻璃珠振荡处理管垢生物膜,得到微生物菌液;菌液过中速滤纸(30~50 μm)并用0.85%生理盐水适当稀释菌液;稀释后将样品加入到Trucount流式管中,然后用Live/Dead Baclight试剂盒避光染色,15 min后过流式细胞仪检测[27]。
1.6 实时荧光定量(real time qPCR)铜绿假单胞菌定量用实时荧光定量PCR仪(7900HT,ABI)完成。扩增引物为oprI-F(5′-GACGTACACGCGAAAGACCT-3′)和oprI-R(3′-GCCCAGAGCCATGTTGTACT-5′),扩增产物为99 bp的基因片段[3]。
qPCR反应体系为10 μL(见表 1),扩增反应体系如下:95 ℃预变性2 min; 95 ℃变性15 s;60 ℃退火、延伸、信号收集,40个循环周期,在延伸阶段读取荧光;60~95 ℃以每升高0.2 ℃读取一次的条件进行溶解曲线检测[28]。同时将克隆质粒进行10倍梯度稀释(45 μL稀释液+5 μL质粒), 选择6个点用于制备标准曲线,阴性对照和样品均重复检测3次,取平均Ct值(cycle threshold, 荧光信号达域值时所经循环数)用于分析。
| 表 1 qPCR反应体系 Tab. 1 Reaction system of qPCR detection |
将提取的样品DNA送往开泰生物公司进行16S rRNA gene高通量测序,简要步骤为:第一轮PCR扩增—纯化PCR产物—第二轮PCR扩增—混库—文库纯化—文库质检—上级测序。
使用R语言vegan包进行PCA分析(principal component analysis)、PCoA分析(principal coordinates analysis),判断组内样本的重复性和组间样本的差异[29]。通过RDA分析(redundancy analysis)探究样本、物种、环境三者之间的关系[30]。
2 结果与讨论 2.1 户内管道模拟平台进出水的水质指标1—3月实验周期内户内管道模拟平台进水及各管道出水水质指标见表 2。对进出水水质进行PCA分析(见图 3),发现HIG和MED出水水质和进水较为接近。RET水样和其他水样有显著差异。
| 表 2 模拟平台进出水水质 Tab. 2 Water quality parameters in simulation platform |

|
图 3 水质指标相关性分析 Fig. 3 PCA analysis of water quality parameters |
如图 4、5所示,水样中细菌总数为RET>SS>LOW>MED>HIG,其中,RET水样细菌总数最大[22, 31]。生物膜中细菌总数为HIG>MED>LOW>RET>SS,这可以用高变流下产生的生物膜更加致密和细菌与生物膜附着度更高来解释。水样和膜样中不同工况下细菌总数变化差异较大,这也说明尽管饮用水中的大多数细菌确实来自生物膜,但生物膜和水中的微生物数量之间并不总是有直接联系,特别是在生物膜生长周期较短的情况下。在HIG生物膜中细菌总数最大,活菌比例也更高,这与之前研究得到的结论一致[31-32],说明高变流的生物膜有更多的生物量[4]。生物膜中活菌的比例在RET工况下最高,这说明停滞使水中细菌总数和生物膜的活菌比例增加,主要是因为在停滞状态下,户内管网水中余氯质量浓度逐渐降低,内壁微生物大量繁殖,在停滞期结束时,水力条件巨变导致管道内部生物膜脱落,水中细菌总数急剧增加,生物膜表面微生物完成更新[20-21]。

|
图 4 水样细菌总拷贝数 Fig. 4 Total bacteria in water sample |

|
图 5 生物膜细菌总拷贝数和活菌比例 Fig. 5 Total number of biofilm bacteria and proportion of viable bacteria |
本实验33个样品高通量测序共获得优化序列2 211 203条。从表 3可以看出,SS水样中细菌种群结构的丰富度和多样性均最高。RET水样中观察到的OTU(operational taxonomic unit)数量最低。水样中细菌种群的多样性为SS>LOW>MED>HIG,这说明随着流量变化减缓,流量趋于稳定时,群落的多样性逐渐提高。和水样结果不同,RET生物膜OTU数量、群落丰度和多样性均最高(表 4)。这与Douterelo等[4]的研究结论不同,主要是因为本研究非循环的条件设置和聚类得到的3种水力工况是基于用户实际的用水情况,相同时间间隔内的总流量并不相同。
| 表 3 水样细菌种群多样性指数 Tab. 3 Bacterial population diversity index of water samples |
| 表 4 膜样细菌种群多样性指数 Tab. 4 Bacterial population diversity index of membrane samples |
如图 6所示,HIG、MED、LOW水样和进水细菌群落结构非常相似,与RET和SS水样存在显著差异。而HIG、MED、LOW膜样间差异性显著,RET和SS膜样分布聚集。这说明流量的变化对膜样中微生物的影响大于其对水样中微生物的影响,而滞留对水样的影响大于其对生物膜的影响[33]。此外,随着流量趋于稳定,水样中微生物的群落结构与生物膜中微生物的群落结构相似性会逐渐增加,到RET工况时水样和膜样群落结构最为相似。

|
注:B代表生物膜样,W代表水样,25为PPR管外径,H代表工况HIG,M代表工况MED,L代表工况LOW,R代表工况RET,SS即为SS工况。 图 6 基于各样品Bray Curtis距离的PCoA图 Fig. 6 PCoA based on Bray Curtis distances of samples |
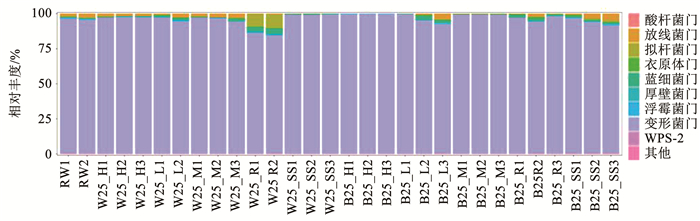
各样品细菌群落在门水平的分布情况如图 7所示,可以看出,无论是在水样还是膜样中,变形菌门都占绝对主导地位(85.16%~99.83%),此外还存在相对丰度较小的放线菌门(0.034%~2.940%),与Zhang等[34]的实验结果一致。在RET水样中还发现有拟杆菌门,相对丰度为9.55%。在属水平(图 8),HIG、MED、LOW水样中铜绿假单胞菌属相对丰度最高,分别为59.06%±4.35%、59.41%±4.43%,24.37%±1.12%。HIG生物膜中铜绿假单胞菌属的平均相对丰度为74.88%,这说明流量的高度变化更有利于假单胞菌属在生物膜上定值,这与先前的研究结果一致[35]。而MED生物膜中优势菌属为水杆菌属,平均相对丰度为84.54%。芽单胞菌属仅出现在RET、SS工况和LOW生物膜中。
|
图 7 各样品细菌群落门水平相对丰度 Fig. 7 Relative abundance of bacterial phylum levels of each sample |

|
注:B代表生物膜样,W代表水样,25为PPR管外径,H代表工况HIG,M代表工况MED,L代表工况LOW,R代表工况RET,SS即为SS工况,RW代表进水,RW1为进水水样平行样1。 图 8 各样品细菌群落属水平相对丰度 Fig. 8 Relative abundance of bacterial genus levels of each sample |
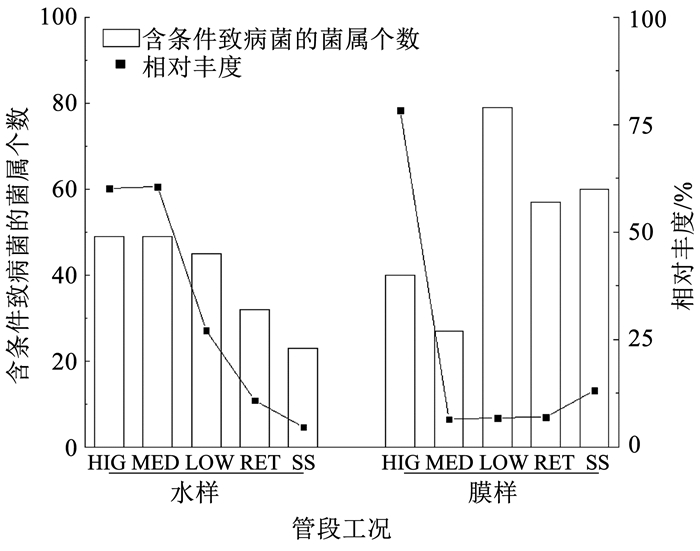
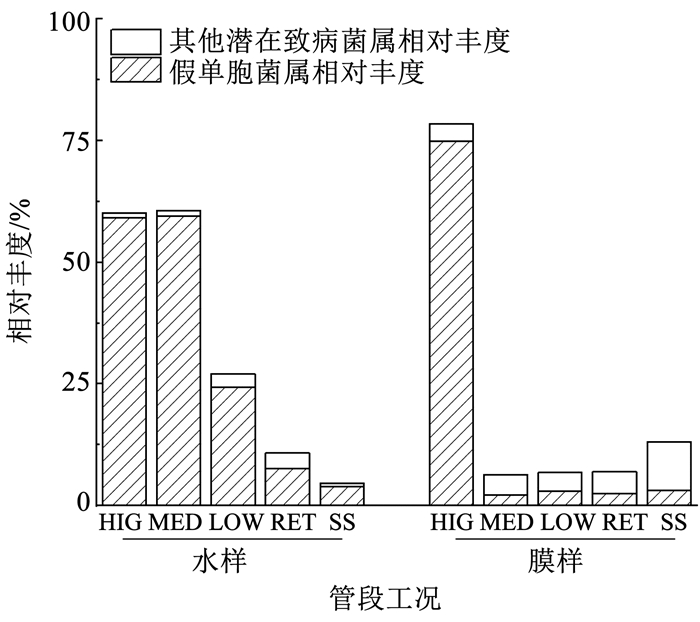
对不同样品中可能含有条件致病菌的菌属[36]进行分析,一共发现81个潜在致病菌属,其相对丰度和菌属个数的分布见图 9。HIG、MED、LOW水样中含条件致病菌的菌属个数和相对丰度分别为49、49、45和60.18%、60.58%、27.10%。SS水样中菌属个数和丰度最小,仅为23个和4.65%。这说明户内管道在间歇性流动工况下水样的潜在致病性较滞留和恒定流量工况均更高。从图 10可以看出,水样中主要潜在致病菌属为假单胞菌属。LOW膜样中含条件致病菌的菌属个数最多(79种),而HIG生物膜中菌属的相对丰度(78.38%)远大于其他工况,其中,假单胞菌属相对丰度为74.88%。对比发现3种间歇性流动工况下的水样潜在致病性表现较为相似,尤其是HIG水样和MED水样在含条件致病菌的属水平相对丰度、组成及数量都几乎相等。HIG工况下水样和生物膜中含条件致病菌属的相对丰度均很高,并且其中主要潜在致病菌属均为假单胞菌属。HIG生物膜和其他工况下的生物膜有显著差异,但是与HIG水样在潜在致病性方面表现出较高相似性。而其他工况下水样和生物膜中样品的潜在致病性没有存在显著的相关性。
|
图 9 样品含条件致病菌的属水平相对丰度及数量 Fig. 9 Relative abundance (histogram) and number (polyline) of bacterial genus that potentially contain opportunistic pathogens |
|
图 10 各样品含潜在致病菌属的相对丰度 Fig. 10 Relative abundance of bacterial genus that potentially contain opportunistic pathogens |
进一步对样品中铜绿假单胞菌进行qPCR定量分析。由图 11可以看出,MED水样中的铜绿假单胞菌拷贝数最大,为(820.98±200.55)/mL。HIG水样中铜绿假单胞菌拷贝数最小,为(480.56±117.38)/mL。对比各工况下生物膜中铜绿假单胞菌总数可知(图 12),间歇性流动工况下铜绿假单胞菌拷贝数更大,其中,HIG生物膜中铜绿假单胞菌拷贝数是LOW生物膜的3.69倍,平均拷贝数达到4 798.81/cm2。SS生物膜铜绿假单胞菌拷贝数最少,仅608/cm2,RET生物膜铜绿假单胞菌平均拷贝数为632.37/cm2。对比水样和生物膜中铜绿假单胞菌数量的变化可知,HIG膜样中铜绿假单胞菌数量极高,HIG水样中铜绿假单胞菌数量反而最低;RET、SS生物膜中铜绿假单胞菌数量较少,RET、SS水样中却不少。说明铜绿假单胞菌更容易在流量变化的生物膜中生长和繁殖。这主要因为铜绿假单胞菌通过产生细胞外聚合物质(EPS)帮助生物膜的定植[37],为其对抗剪切力的变化提供额外保护,从而防止其脱落[28]。

|
图 11 水样中铜绿假单胞菌拷贝数 Fig. 11 Pseudomonas aeruginosa counts in water samples |

|
图 12 膜样中铜绿假单胞菌拷贝数 Fig. 12 Pseudomonas aeruginosa counts in biofilm samples |
冗余性分析(RDA)用于确定影响假单胞菌属和铜绿假单胞菌数量的特定环境因素。图 13结果显示,铜绿假单胞菌分布受到许多环境因素的共同影响,RDA1和RDA2解释了总差异的56.79%(P < 0.05),其中,pH和浊度是最重要的解释变量,且与铜绿假单胞菌数量和假单胞菌属数呈正相关。

|
图 13 假单胞菌属及铜绿假单胞菌数量与环境参数关系的冗余分析 Fig. 13 Redundancy analysis (RDA)of the relationship between bacterial Pseudomonas aeruginosa counts and environmental parameters |
1) 在户内管道RET水样中细菌总数最大,HIG生物膜中细菌总数最高,RET生物膜中的活菌比例最高。
2) 随着流量变化减缓,水样中群落的丰富度和多样性逐渐提高。RET生物膜中OTU数量、群落丰度和多样性均最高。
3) 不同的水力条件对生物膜和水样的影响程度不同。流量的变化对膜样中微生物的影响大于其对水样中微生物的影响,滞留对水样的影响则大于其对生物膜的影响。此外,随着流量变化减小,水样中微生物的群落结构与生物膜中微生物的群落结构相似性会逐渐增加,到RET工况时水样和膜样群落结构最为相似。
4) HIG、MED、LOW水样中含条件致病菌的菌属个数和相对丰度分别为49、49、45和60.18%、60.58%、27.10%,均大于滞留工况。MED水样中铜绿假单胞菌拷贝数最高,HIG生物膜中铜绿假单胞菌拷贝数最高,达到4 798.81/cm2,是滞留工况下的7.59倍。而LOW生物膜中含条件致病菌的菌属个数最多有79种。经分析浊度和pH分别是假单胞菌属和铜绿假单胞菌的主要环境影响因素。实验结果表明,在户内管道特殊生境下,除滞留工况外,间歇性用水工况同样需要引起关注。
| [1] |
ZLATANOVICĆ L, VAN DER HOEK J P, VREEBURG J H G. An experimental study on the influence of water stagnation and temperature change on water quality in a full-scale domestic drinking water system[J]. Water Research, 2017, 123: 761. DOI:10.1016/j.watres.2017.07.019 |
| [2] |
LESLIE E, HINDS J, HAI F I. Causes, factors, and control measures of opportunistic premise plumbing pathogens: a critical review[J]. Applied Sciences, 2021, 11(10): 4474. DOI:10.3390/app11104474 |
| [3] |
FALKINHAM J O, HILBORN E D, ARDUINO M J, et al. Epidemiology and ecology of opportunistic premise plumbing pathogens: Legionella pneumophila, Mycobacterium avium, and Pseudomonas aeruginosa[J]. Environmental Health Perspectives, 2015, 123(8): 749. DOI:10.1289/ehp.1408692 |
| [4] |
DOUTERELO I, SHARPE R L, BOXALL J B. Influence of hydraulic regimes on bacterial community structure and composition in an experimental drinking water distribution system[J]. Water Research, 2013, 47(2): 503. DOI:10.1016/j.watres.2012.09.053 |
| [5] |
LIU Lizhong, XING Xueci, HU Chun, et al. One-year survey of opportunistic premise plumbing pathogens and free-living amoebae in the tap-water of one northern city of China[J]. Journal of Environmental Sciences, 2019, 77: 20. DOI:10.1016/j.jes.2018.04.020 |
| [6] |
LAUTENSCHLAGER K, BOON N, WANG Y, et al. Overnight stagnation of drinking water in household taps induces microbial growth and changes in community composition[J]. Water Research, 2010, 44(17): 4868. DOI:10.1016/j.watres.2010.07.032 |
| [7] |
李欢, 赵建夫, 王虹. 饮用水输配系统中条件致病菌的健康风险和生长因素[J]. 中国给水排水, 2017, 33(10): 41. LI Huan, ZHAO Jianfu, WANG Hong. Health risks and growth factors of conditional pathogenic bacteria in drinking water transmission and distribution system[J]. China Water & Wastewater, 2017, 33(10): 41. DOI:10.19853/j.zgjsps.1000-4602.2017.10.009 |
| [8] |
李涛, 李佳. 成都市生活饮用水中铜绿假单胞菌的污染调查[J]. 环境与健康杂志, 2014, 31(4): 349. LI Tao, LI Jia. Investigation of Pseudomonas aeruginosa pollution in drinking water in Chengdu[J]. Journal of Environment and Health, 2014, 31(4): 349. DOI:10.16241/j.cnki.1001-5914.2014.04.016 |
| [9] |
PROCTOR C R, DAI D, EDWARDS M A, et al. Interactive effects of temperature, organic carbon, and pipe material on microbiota composition and Legionella pneumophila in hot water plumbing systems[J]. Microbiome, 2017, 5: 130. DOI:10.1186/s40168-017-0348-5 |
| [10] |
XUE Z, HESSLER C M, PANMANEE W, et al. Pseudomonas aeruginosa inactivation mechanism is affected by capsular extracellular polymeric substances reactivity with chlorine and monochloramine[J]. FEMS Microbiology Ecology, 2013, 83(1): 101. DOI:10.1111/j.1574-6941.2012.01453.x |
| [11] |
LAVENIR R, SANROMA M, GIBERT S, et al. Spatio-temporal analysis of infra-specific genetic variations among a Pseudomonas aeruginosa water network hospital population: invasion and selection of clonal complexes[J]. Journal of Applied Microbiology, 2008, 105(5): 1491. DOI:10.1111/j.1365-2672.2008.03907.x |
| [12] |
RAYA A, SODAGARI M, PINZON N M, et al. Effects of rhamnolipids and shear on initial attachment of Pseudomonas aeruginosa PAO1 in glass flow chambers[J]. Environ Sci Pollut Res, 2010, 17: 1529. DOI:10.1007/s11356-010-0339-6 |
| [13] |
LIU Z, LIN Y E, STOUT J E, et al. Effect of flow regimes on the presence of Legionella within the biofilm of a model plumbing system[J]. Journal of Applied Microbiology, 2010, 101(2): 437. |
| [14] |
WANG Hong, MASTERS S, EDWARDS M A, et al. Effect of disinfectant, water age, and pipe materials on bacterial and eukaryotic community structure in drinking water biofilm[J]. Environmental Science and Technology, 2014, 48(3): 1426. DOI:10.1021/es402636u |
| [15] |
REVETTA R P, GOMEZ-ALVAREZ V, GERKE T L, et al. Establishment and early succession of bacterial communities in monochloramine-treated drinking water biofilms[J]. FEMS Microbiology Ecology, 2013, 86(3): 404. DOI:10.1111/1574-6941.12170 |
| [16] |
DOUTERELO I, HUSBAND S, BOXALL J B. The bacteriological composition of biomass recovered by flushing an operational drinking water distribution system[J]. Water Research, 2014, 54: 100. DOI:10.1016/j.watres.2014.01.049 |
| [17] |
刘新民, 葛涛, 杨金平, 等. 塑料管材的发展概况及市场调查[J]. 塑料科技, 2003(6): 41. LIU Xinmin, GE Tao, YANG Jinping, et al. Development overview and market survey of plastic pipes[J]. Plastic Science and Technology, 2003(6): 41. |
| [18] |
柳江华, 管运涛, 赵婉婉, 等. 管材对给水管附生生物膜微生物分布的影响[J]. 西北农林科技大学学报(自然科学版), 2007(1): 143. LIU Jianghua, GUAN Yuntao, ZHAO Wanwan, et al. Influence of pipe materials on microbial distribution of biofilms attached to water supply pipes[J]. Journal of Northwest A&F University (Natural Science Edition), 2007(1): 143. DOI:10.13207/j.cnki.jnwafu.2007.01.030 |
| [19] |
柳景青. 调度时用水量预测的系统理论方法及应用研究[D]. 杭州: 浙江大学, 2005 LIU Jingqing. Research on system theory method and application of water consumption prediction during dispatching[D]. Hangzhou: Zhejiang University, 2005 |
| [20] |
WANG Hong, MASTERS S, FALKINHAM J O, et al. Distribution system water quality affects responses of opportunistic pathogen gene markers in household water heaters[J]. Environmental Science & Technology, 2015, 49(14): 8416. DOI:10.1021/acs.est.5b01538 |
| [21] |
WILLIAMS K, PRUDEN A, FALKINHAM J O, et al. Relationship between organic carbon and opportunistic pathogens in simulated glass water heaters[J]. Pathogens, 2015, 4(2): 355. DOI:10.3390/pathogens4020355 |
| [22] |
ZLATANOVIĆ L, VAN DER HOEK J P, VREEBURG J H G. An experimental study on the influence of water stagnation and temperature change on water quality in a full-scale domestic drinking water system[J]. Water Research, 2017, 123: 761. DOI:10.1016/j.watres.2017.07.019 |
| [23] |
RHOADS W J, PRUDEN A, EDWARDS M A. Convective mixing in distal pipes exacerbates legionella pneumophila growth in hot water plumbing[J]. Pathogens, 2016, 5(1): 29. DOI:10.3390/pathogens5010029 |
| [24] |
王若玮, 许仕荣, 罗志逢, 等. 环氧树脂封面层对球墨铸铁管生物膜的影响[J]. 中国环境科学, 2019, 39(5): 2014. WANG Ruowei, XU Shirong, LUO Zhifeng, et al. Effect of epoxy resin cover on biofilm of ductile iron pipe[J]. China Environmental Science, 2019, 39(5): 2014. DOI:10.19674/j.cnki.issn1000-6923.2019.0240 |
| [25] |
PENG H, SHAO Y, ZHANG Y, et al. Optimization of ultrasonic parameters for effective detachment of biofilm cells in an actual drinking water distribution system[J]. Journal of Zhejiang University: Science A, 2020, 21(3): 167. DOI:10.1631/jzus.A1900416 |
| [26] |
李艺, 彭宏熙, 陈环宇, 等. 宏基因组测序法研究管材对生物膜致病菌的影响[J]. 哈尔滨工业大学学报, 2021, 53(11): 21. LI Yi, PENG Hongxi, CHEN Huanyu, et al. Study on the influence of pipes on biofilm pathogens by macrogenome sequencing[J]. Journal of Harbin Institute of Technology, 2021, 53(11): 21. |
| [27] |
黄佳佳. 实际供水管道管壁生物膜菌落属性及其影响因素研究[D]. 杭州: 浙江大学, 2014 HUANG Jiajia. Study on biofilm colony properties and influencing factors of actual water supply pipeline wall[D]. Hangzhou: Zhejiang University, 2014 |
| [28] |
LINDEN K G, HULL N M, RODRIGUEZ R A. Comment on "UV disinfection induces a VBNC state in Escherichia coli and Pseudomonas aeruginosa"[J]. Environmental Science & Technology, 2015, 49(17): 10750. DOI:10.1021/acs.est.5b02534 |
| [29] |
WARTON D I, WRIGHT S T, YI W. Distance-based multivariate analyses confound location and dispersion effects[J]. Methods in Ecology & Evolution, 2012, 3(1): 21. |
| [30] |
BRAAK C T. CANOCO: a FORTRAN program for canonical community ordination by partial detrended canonical correspondence analysis, principal components analysis and redundancy analysis[J]. [S. l. ]: Agricultural Mathematics Group, 1988
|
| [31] |
LEHTOLA M J, LAXANDER M, MIETTINEN I T, et al. The effects of changing water flow velocity on the formation of biofilms and water quality in pilot distribution system consisting of copper or polyethylene pipes[J]. Water Research, 2006, 40(11): 2151. DOI:10.1016/j.watres.2006.04.010 |
| [32] |
BÉDARD E, PRÉVOST M, DÉZIEL E. Pseudomonas aeruginosa in premise plumbing of large buildings[J]. MicrobiologyOpen, 2016, 5(6): 937. DOI:10.1002/mbo3.391 |
| [33] |
王若玮. 淋浴软管滞留水微生物再生长影响因素及其溯源研究[D]. 长沙: 湖南大学, 2019 WANG Ruowei. Study on the influencing factors of microbial regrowth in the retention water of shower hose and its source[D]. Changsha: Hunan University, 2019 |
| [34] |
ZHANG Haihan, XU Lei, HUANG Tinglin, et al. Combined effects of seasonality and stagnation on tap water quality: changes in chemical parameters, metabolic activity and co-existence in bacterial community[J]. Journal of Hazardous Materials, 2021, 403: 124018. DOI:10.1016/j.jhazmat.2020.124018 |
| [35] |
GORAJ W, PYTLAK A, KOWALSKA B, et al. Influence of pipe material on biofilm microbial communities found in drinking water supply system[J]. Environmental Research, 2021, 196: 110433. DOI:10.1016/j.envres.2020.110433 |
| [36] |
ZHANG Shaoqing, HE Zhili, MENG Fangang. Floc-size effects of the pathogenic bacteria in a membrane bioreactor plant[J]. Environment International, 2019, 127: 645. DOI:10.1016/j.envint.2019.04.002 |
| [37] |
XUE Zheng, SENDAMANGALAM V R, GRUDEN C L, et al. Multiple roles of extracellular polymeric substances on resistance of biofilm and detached clusters[J]. Environmental Science & Technology, 2012, 46(24): 13212. DOI:10.1021/es3031165 |
 2024, Vol. 56
2024, Vol. 56


