2. 哈尔滨工业大学(深圳) 经济管理学院,广东 深圳 518055;
3. 深圳能源环保股份有限公司,广东 深圳 518048;
4. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090;
5. 深圳市水资源利用与环境污染控制重点实验室(哈尔滨工业大学(深圳)),广东 深圳 518055;
6. 城市高浓度废水处理与资源化实验室(校企联合),广东 深圳 518055
2. School of Economics and Management, Harbin Institute of Technology, Shenzhen, Shenzhen 518055, Guangdong, China;
3. Shenzhen Energy Environmental Protection Co., Shenzhen 518048, Guangdong, China;
4. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China;
5. Shenzhen Key Laboratory of Water Resource Utilization and Environmental Pollution Control (Harbin Institute of Technology, Shenzhen), Shenzhen 518055, Guangdong, China;
6. Joint Laboratory of Urban High Strength Wastewater Treatment and Resources Utilization, Shenzhen 518055, Guangdong, China
目前,城市河道外源污染问题已基本得到有效控制,但由河道底泥引发的“內源”污染依旧对水体造成一定的影响。研究表明,持久性有机物多环芳烃(polycyclic aromatic hydrocarbons, PAHs)广泛存在于河道污染底泥中[1-3],由于其具有致畸、致癌、致突变的危害[4],一直都是河道“内源”污染治理的重难点。美国环境保护署(USEPA)将16种PAHs列为优先控制污染物,主要分为低分子质量PAHs(2~3环),包括萘、苊烯、苊、菲、蒽;中分子质量PAHs(4环),包括荧蒽、芘、苯并[a]蒽、芘;高分子质量PAHs(5~6环),包括苯并[b]蒽、苯并[k]荧蒽、苯并[a]芘、二苯并[a, h]蒽和苯并[g, h, i]芘[5]。目前,针对底泥中以16种PAHs为代表的难降解有机物污染,主要采用强化生物共代谢技术进行处理[5-9]。生物共代谢通过向底泥中投加外源营养物质,如乙酸钠、葡萄糖、邻苯二甲酸、甲醇等[10]作为碳源,促进底泥土著微生物生长繁殖,进而代谢底泥中PAHs等难降解的污染物质[10-11]。因此,微生物菌群是决定共代谢体系降解目标污染物效果的核心[12-16]。
前期研究表明,微生物共代谢降解底泥PAHs中,温度和pH是重要的影响因素。Zhong等[17]研究了温度对共代谢降解PAHs的影响,表明温度对PAHs降解速率影响较大,温度越高,PAHs降解速率越快,但温度对PAHs降解率无明显影响。Tam等[18]研究了底泥pH对共代谢降解PAHs的影响,发现底泥pH对PAHs降解率影响较大,不同微生物对环境pH的要求存在一定差异,底泥碱性越强,PAHs降解率越高。但吴华财等[19-20]的研究表明,高盐环境会改变反应介质的渗透压而影响微生物活性,因此,盐度对微生物共代谢降解底泥中污染物也具有一定的影响。感潮河段水质较常规河道具有高盐度、高硫酸盐的特性,且上覆水受潮汐反复冲刷的影响,盐度不断波动,对底泥中PAHs共代谢降解、底泥微生物群落变化及关键酶的活性、代谢速率等产生了不可预知的影响。
为此,结合目前主流微生物共代谢中添加的外源营养物质种类[8, 21],通过前期小试试验确定乙酸钠和邻苯二甲酸组合对感潮河段底泥PAHs的降解效果最好[22],并考察了不同盐度波动下基于乙酸钠和邻苯二甲酸为外加碳源的微生物共代谢体系对河道底泥PAHs降解效果,总有机碳(total organic carbon,TOC)和硫化物(SO42-、酸可挥发性硫化物(acid volatile sulfide, AVS))质量浓度及理化指标(pH、氧化还原电位(oxidation-reduction potential, ORP))的变化,探究了不同盐度下底泥微生物共代谢过程中的微生物群落响应,以期为基于微生物共代谢法降解感潮河段底泥PAHs的影响研究提供理论支撑。
1 实验 1.1 底泥的采集试验底泥取自南方某市某河下游入海口感潮段,取样点靠近珠江口(北纬22°75′5718″,东经113°79′1108″),潮汐特征为不规则半日潮,每天受两次涨落潮影响,日平均潮差1.2 m,上覆水盐度整体波动范围为7‰~18‰。采用抓斗采样器取样,采样深度为0~60 cm。采集的底泥及上覆水污染物本底值如表 1所示。
| 表 1 供试底泥及上覆水本底值 Tab. 1 Background value of tested sediment and overlying water |
本试验系统由模拟河道、进水海水箱、进水淡水箱和退水水箱组成(图 1),泥水体积比为1∶ 4,水力停留时间为12 h。共5组实验,每组进水水箱中配水盐度不同,配水盐度及反应器主要参数如表 2所示。根据河道底泥及上覆水的实际情况,试验系统温度控制在(25±5)℃。考虑试验所用底泥的取样潮汐河段为不规则半日潮,每天高低潮各两个,一个半日潮之间间隔约12 h,故每日早8:00用蠕动泵定时从盐水箱泵入人工海水以模拟海水涨潮,从淡水箱泵入等体积的自来水以模拟上游径流,从最低水位到最高水位之间时间间隔设置为1 h。每日晚20:00定时打开排水管出水以模拟退潮,保留一定体积的出水进入海水水箱,第二天作为涨潮海水重新进入反应器,以模拟近海河道受潮汐影响时往复流的特点,试验周期90 d。

|
图 1 试验装置 Fig. 1 The experimental set-up |
| 表 2 反应器主要参数 Tab. 2 Main parameters of reactor |
底泥中投加的共代谢药剂为乙酸钠耦合邻苯二甲酸的复配药剂,乙酸钠作为共代谢反应的主要碳源,邻苯二甲酸作为底泥微生物好氧共代谢反应的促进剂,单位干泥投加量依据前期预实验[22]最终确定为乙酸钠40 mg/g,邻苯二甲酸0.02 mg/g。
1.3 样品处理、分析和质量控制样品处理:准确称取15.0 g底泥样品置离心管(250 mL)中,加入30 mL体积比为1∶ 1的二氯甲烷-丙酮溶液静置2 h,匀浆提取1 min后,微波振荡提取15 min,10 000 r/min转速下离心分离5 min,提取过程重复2次,取上层有机相清液5 mL,用浓缩仪40 ℃浓缩干,正己烷定容至2.5 mL,漩涡15 s后过0.22 μm滤膜至进样瓶,等待上机。
样品分析:用气相色谱-质谱联用仪(GC-MS,Agilent 6890 Plus GC-5973MSD,美国)对底泥中16种PAHs进行分析,采用两种升温分析程序。仪器分析条件及升温分离程序如下:选择性离子扫描模式(SIM)定量,HP-5MS细管色谱柱(30 m×0.25 mm× 0.25 μm),以He作载气,流速mL/min;无分流进样(进样体1 μL),进样口温度280 ℃,PAHs测定初始炉温60 ℃;程序升温到300 ℃(5 ℃/min),整个程序运行时间68 min。MS条件: EI电离源70 eV,离子源温度230 ℃,扫描范围50~550 u。
质量控制:实验过程进行严格的质量控制,根据特征分子离子峰、保留时间以及质谱图的质谱数据库(NIST2002)匹配分析对样品中的组分进行定性分析,用指示物的回收率监测和评价实验质量。为了保证数据质量,采用了方法空白和样品平行样等质控手段,控制实验流程中的人为因素污染以及操作过程的准确性。16种PAHs的标准曲线相关系数均大于99.9%,底泥样品中一批测13个样,包括1个空白、1个平行、1个加标回收率,有效数据10个,PAHs的空白加标回收率为75.5%~100%。
1.4 检测方法 1.4.1 常规指标检测方法底泥常规指标的检测主要包括pH、ORP、AVS、SO42-、TOC。pH和ORP采用多参数水质测定仪(YSI pro1020,美国)测定。底泥AVS采用酸吹脱仪吹脱后用亚甲基蓝分光光度法分析测定,底泥SO42-质量浓度采用清水浸提后用离子色谱(IC)分析测定, 底泥TOC采用高温灼烧法测定。各测定值中的底泥质量均以干质量计。
1.4.2 微生物群落结构测定底泥细菌总DNA提取、PCR操作和16S rRNA测序由上海美吉生物医药公司完成。首先,采用Power Soil DNA提取试剂盒(MO Biomedical,U. S.)对样本中的DNA进行提取;然后,选取细菌基因的V3~V4区进行聚合酶链式反应(PCR)扩增,引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′), 806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系(20 μL):5×FastPfu Buffer 4 μL,dNTPs 2 μL,引物各0.8 μL,FastPfu聚合酶0.4 μL,模板DNA 10 ng,加无菌水至20 μL。PCR条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环,最后72 ℃延伸5 min。2%(质量分数)琼脂糖凝胶电泳检测PCR产物,PCR采用ABI GeneAmp 9700型PCR仪。在使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物后,用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后, 根据每个样本的不同测序量要求进行相应比例混合。最后, 按照Illumina MiSeq平台的测序要求进行测序。
1.4.3 数据处理与分析采用Excel 2021和Origin 2018进行数据处理和作图,运用SPSS 20.0进行单因素方差(ANOVA)分析,采用最小显著差异法(LSD)比较数据组间的差异(P < 0.05)。采用Mothur软件计算土中细菌的ACE指数、Chaol指数、Shannon指数和Simpson指数,采用R语言的“gtern”包对不同样本的物种组成进行比较分析。
2 结果与讨论 2.1 多环芳烃的降解效果上覆水不同盐度波动条件下(0~50‰),90 d内底泥微生物共代谢降解PAHs质量分数变化如图 2所示。随着上覆水盐度波动,底泥中16种PAHs的降解率经历了两次大幅下降。当盐度波动从0~20‰升高到>20‰~40‰时,PAHs的降解率从42.0%下降至29.0%;当盐度波动从>20‰~40‰升高到>40‰~50‰时,PAHs的降解率从29.2%下降至12.9%。低盐环境(0~20‰)下底泥PAHs的降解率是高盐环境(>20‰~50‰)的1.5~3.3倍。在反应第90天时,0~10‰、>10‰~20‰、>20‰~30‰、>30‰~40‰和>40‰~50‰盐度条件下底泥PAHs的质量分数分别为3 073、3 117、3 821、3 809和4 683 μg/kg。这些结果表明盐度的升高对共代谢降解底泥PAHs具有显著影响(P < 0.05),这是因为高盐环境会抑制传统微生物的生长和降解能力,破坏正常的代谢功能,抑制PDO、C12O、C23O等关键的PAHs降解酶活性[23]。彭子淇等[24]也证明,高盐度环境会迫使PAHs降解菌发生脱水和PDO、C12O酶失活,致使PAHs降解率较低。Thomas和Vijendra等[25-26]的研究表明,共代谢降解过程主要通过促进PAHs降解菌的生长富集来加强PAHs的降解。本研究在相同菌群特征的5组供试底泥中,给予同等的碳源水平,乙酸钠为底泥土著微生物的生长提供了优质的碳源,邻苯二甲酸作为酶促反应的中间产物,有效促进了厌氧降解反应的正向进行[27]。随着不同反应体系中盐度的升高,PAHs的去除率逐渐降低,可见过高盐度会抑制底泥微生物共代谢降解PAHs。

|
图 2 上覆水盐度波动对PAHs降解效果的影响 Fig. 2 Effect of salinity fluctuation of overlying water on PAHs degradation |
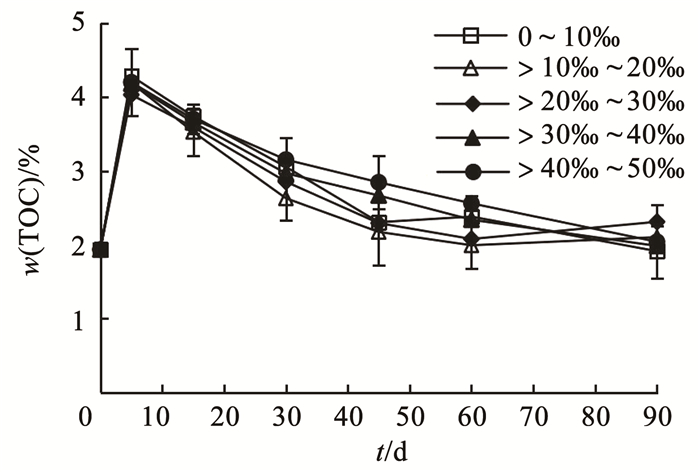
不同盐度波动条件下,底泥微生物共代谢降解周期90 d内TOC质量分数的变化如图 3所示。共代谢全周期内不同上覆水盐度条件下,TOC质量分数均呈现先上升,然后缓慢下降并逐渐稳定的趋势。不同盐度下底泥TOC的质量分数在前10 d内均有提高,这是因为共代谢中添加的乙酸钠和邻苯二甲酸为外加碳源,使得底泥中TOC质量分数迅速升高。反应前期(第0~60天),上覆水盐度在低盐(>10‰~30‰)条件下TOC降解率高于上覆水过低盐度(0~10‰)和高盐度(>30‰~50‰)情形。共代谢反应后期(第60~90天),不同上覆水盐度波动条件下,TOC降解率相近。5组实验组反应60 d时,底泥TOC的质量分数分别为2.38%、1.99%、2.08%、2.34%和2.56%,反应90 d时,各组底泥TOC的质量分数分别为1.91%、2.10%、2.31%、1.99%和2.04%,上覆水盐度不再是共代谢降解TOC的限制因素。共代谢前期低盐环境(>10‰~30‰)底泥TOC降解率是过低盐环境(0~10‰)的1.1~1.2倍,高盐环境(>30‰~50‰)的1.1~1.3倍(P < 0.05)。前期过低盐度上覆水(0~10‰)TOC降解效果相对较低,原因可能是过低盐环境下降解TOC的相关微生物为非优势菌属[28];前期高盐环境(>30‰~50‰)下,TOC降解效果同样受到限制,这是因为高盐环境会抑制土著微生物的代谢,致使共代谢速率下降,导致底泥TOC残留量较高[29];而后期盐度对TOC降解率的影响降低,这可能与后期盐度达到泥-水平衡有关[30]。因此,适宜的上覆水盐度对底泥TOC的降解效果具重要意义。
|
图 3 上覆水盐度波动对TOC降解效果的影响 Fig. 3 Effect of salinity fluctuation of overlying water on TOC degradation |
上覆水不同盐度波动条件下,微生物共代谢90 d内底泥pH的变化如图 4(a)所示。当上覆水盐度较低(0~20‰)时,底泥pH在90 d代谢周期中呈现先降低后升高的趋势。当上覆水盐度波动范围为0~10‰时,共代谢反应在第0~7天,底泥pH从7.58下降至7.17;第7~90天,底泥pH逐步上升至8.11。上覆水盐度波动范围在>10‰~20‰时,反应在第0~7天时,底泥pH从7.58下降至7.10;第7~90天时,底泥pH逐步上升至8.02。上覆水盐度较高(>30‰~50‰)时,底泥pH在反应过程中呈现持续小幅度下降趋势。上覆水盐度波动范围在40‰~50‰时,底泥pH下降幅度最大,反应90 d时pH降至7.01,表明随着盐度升高底泥pH有下降的趋势,但差异水平不显著(P>0.05)。在反应过程中,前期pH的下降可能与反应过程中产生有机酸有关。Michael等[31]研究表明,微生物共代谢分解大分子物质的过程中会产生乙酸和丙酸等中间产物,致使反应介质酸性增加;而后期造成不同盐度段pH显著差异的原因可能是底泥中SO42-的质量浓度差异[32]。在低盐度的底泥环境中,SO42-质量浓度一般低于1 000 mg/L,此时底泥中各种代谢反应同时发生,包括硫酸盐还原和产甲烷过程[33]。硫酸盐还原过程导致H2S酸性气体的产生,产甲烷过程利用CO2等原料生成CH4[34],伴随H2S和CH4的溢散底泥碱度增大。但在高盐环境下,高渗透压使底泥中多数厌氧微生物菌群脱水而失活[25],引发底泥中的厌氧产酸和产甲烷反应过程停滞,故pH波动较小。

|
图 4 上覆水盐度波动对底泥pH和ORP变化的影响 Fig. 4 Effect of salinity fluctuation of overlying water on the changes of sediment pH and ORP |
上覆水不同盐度波动条件下,底泥微生物共代谢90 d内ORP的变化如图 4(b)所示。
在整个代谢周期内,随着共代谢反应的进行,底泥ORP整体呈下降趋势。当上覆水盐度较低(0~20‰)时,底泥ORP下降显著,反应90 d时,0~10‰、>10‰~20‰盐度条件下底泥ORP分别为-369、-333 mV;当上覆水盐度较高(>20‰~50‰)时,底泥ORP下降相比低盐环境受到一定程度抑制,反应90 d时,>20‰~30‰、>30‰~40‰、>40‰~50‰盐度条件下底泥ORP分别为-287、-269、-284 mV。由此可知,过高的盐度会对底泥中的微生物厌氧代谢过程造成一定的抑制,减缓ORP的下降。这主要是由于高盐环境产生的高渗透压会使底泥中多数厌氧微生物脱水而失去活性,抑制了底泥中厌氧代谢反应,改变微生物群落结构[19-20],使得微生物共代谢反应和速率下降。
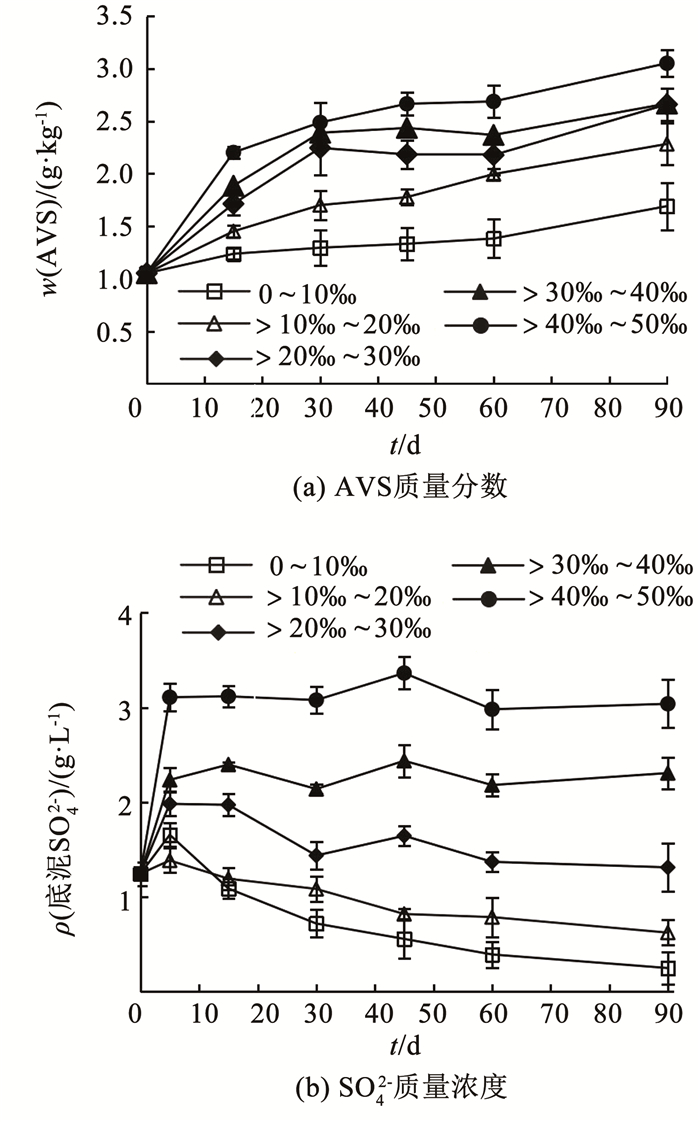
2.4 底泥硫形态的转化 2.4.1 AVS质量分数不同盐度波动条件下,微生物共代谢90 d内底泥AVS质量分数如图 5(a)所示。各实验组底泥AVS质量分数均呈逐渐上升的趋势,反应90 d时,随着盐度的升高,不同实验组AVS质量分数分别为1 691、2 283、2 667、2 660、3 051 mg/kg。这主要是由于盐度越高的上覆水中SO42-质量浓度越高,表明盐度的升高对底泥AVS质量分数具有显著影响(P < 0.05)。因此,在浓度差的作用下SO42-向底泥中转移的当量越多。所以,在共代谢反应的长周期内,经硫酸盐还原菌还原作用后转化成的硫化物当量越高。在共代谢反应前20 d时,随上覆水盐度的升高,底泥AVS质量分数呈梯度升高,而在反应20 d后,高盐环境(>20‰~50‰)下AVS的上升速率明显减缓。这是由于过高的盐度会抑制底泥中PAHs降解菌群的活性[35],进而抑制厌氧共代谢降解反应的发生,SO42-的厌氧还原反应也会受到一定的影响,还原产物S2-也相应减少。
|
图 5 上覆水盐度波动对底泥AVS和SO42-变化的影响 Fig. 5 Effect of salinity fluctuation of overlying water on the changes of sediment AVS and SO42- contents |
同盐度波动条件下,微生物共代谢90 d内底泥SO42-质量浓度变化见图 5(b)。在低盐环境(0~10‰)下,底泥SO42-质量浓度呈逐渐下降趋势,从1 245 mg/L下降至248 mg/L;在高盐环境(>20‰~50‰)下,底泥SO42-质量浓度虽不断波动但无明显下降趋势,盐度为>20‰~30‰、>30‰~40‰、>40‰~50‰的上覆水环境,底泥SO42-质量浓度分别保持在1 311、2 308、3 039 mg/L左右。这些结果表明盐度的升高对底泥SO42-具有显著影响(P < 0.05)。结合底泥理化指标和AVS质量分数变化可知,微生物共代谢反应的过程中会导致底泥厌氧状态加剧,对应的底泥ORP下降,使SO42-向S2-转化,对应的底泥中AVS质量分数逐渐升高。同时,由于泥-水两相界面存在离子扩散效应[36],底泥SO42-会从质量浓度较高的液相扩散至质量浓度较低的固相中,直至固-液相间SO42-质量浓度平衡。另外,在低盐环境下,底泥硫酸根还原菌未受高盐度影响,SO42-质量浓度显著下降,与底泥PAHs质量分数降低显著相关(P < 0.05)。这主要是因为在硫酸盐还原条件下可有效促进PAHs的降解。Chang等[37]考察了3种不同厌氧条件下对PAHs降解效果的影响,结果表明,生物降解率从高到低的顺序是硫酸盐还原条件>产甲烷条件>硝酸盐还原条件。所以,在厌氧降解PAHs过程中,硫酸盐还原菌、产甲烷菌和真菌都参与了PAHs的降解,且硫酸盐还原菌可能是构成适应PAHs降解菌群的主要组成部分。
2.5 底泥微生物群落响应 2.5.1 微生物群落的丰富度和多样性对不同上覆水盐度波动条件下底泥微生物群落的丰富度和多样性进行分析,每个样本获得超过76 000个序列(表 3)。低盐度环境(0~10‰)下底泥中的OTUs总数较高(774),当盐度上升到>40‰~50‰时,OTUs总数下降为616。不同上覆水盐度波动条件下,底泥样本微生物多样性指标Shannon指数在5.663~6.369变化,Simpson指数在0.006~0.032变化。其中,Shannon指数与上覆水盐度呈正相关,上覆水盐度越高,Shannon指数越高;Simpson指数与上覆水盐度呈负相关,上覆水盐度越高,Simpson指数越低。Shannon指数和Simpson指数分别反映了微生物群落的异质性和多样性[38-39],可见上覆水盐度越高时样品中微生物群落均匀性越差;上覆水盐度越低时样品中微生物个体分配越均匀。
| 表 3 不同上覆水盐度波动条件下底泥细菌多样性指数 Tab. 3 Bacterial diversity index of sediment under different overlying water salinity fluctuation conditions |
表 3中的覆盖率指数为0.977~0.981,表明本研究构建的序列库涵盖了微生物群落的多样性,5组样品中上覆水盐度越低的组别覆盖率指数越高。Chaol指数为3 160~3 748,ACE指数变化范围为3 201~3 848。其中,低盐度环境(0~10‰)下底泥样品中Chao1指数和ACE指数都是5组中最高,表明在低盐环境下底泥样品中微生物物种数最多。高盐度环境(>40‰~50‰)下底泥样品中Chao1指数和ACE指数都是5组中最低,表明厌氧微生物对盐度胁迫环境的适应性,在上覆水盐度较高的环境条件下,底泥微生物种类数量减少但生物多样性得以保持稳定。
2.5.2 微生物群落结构的变化通过高通量测序技术分析底泥样品中细菌群落特性,解析上覆水盐度波动变化对微生物群落结构的影响。所有底泥样本的OTUs均在97%鉴别阈值控制内。门水平和属水平上底泥微生物群落的变化如图 6所示。
|
图 6 不同上覆水盐度波动下底泥微生物门水平群落组成图和属水平群落丰度热图 Fig. 6 Horizontal community composition diagram and genus level community abundance heat map of sediment microbial phylum under different overlying water salinity fluctuations |
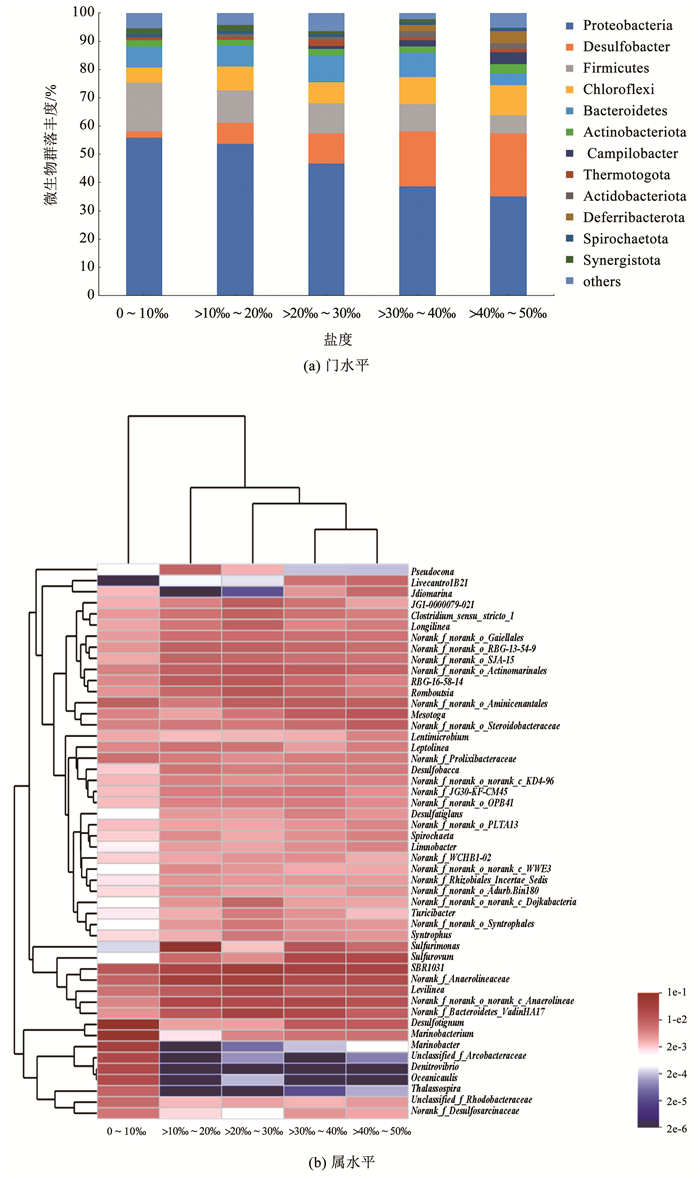
图 6(a)显示,低盐度环境下(0‰~10‰)底泥样品中微生物群落主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)3个优势菌门组成,分别占比52%、16%和7%。随着盐度增加,Proteobacteria和Firmicutes种群丰度逐渐降低;相反,脱硫杆菌门(Desulfobacter)和绿弯菌门(Chloroflexi)的丰度显著增加。低盐度环境(0~10‰)中,Desulfobacter和Chloroflexi种群丰度占比分别为2%和5%,当上覆水盐度逐步增加至高盐(>40‰~50‰)状态时,Desulfobacter和Chloroflexi种群丰度占比达到21%和10%。已有报导表明, Proteobacteria和Firmicutes是典型的芳烃类污染物高效降解菌[40]。Firmicutes可以诱导底泥中大分子有机物快速向代谢中间产物有机酸转化,进而加快共代谢降解PAHs的速率[41]。由此可推测,上覆水盐度是通过抑制Proteobacteria和Firmicutes这两类污染物降解菌群的丰度,进而导致共代谢降解PAHs的能力下降。Desulfobacter是一种化能自养型细菌[42],在氧化硫化物的过程中获得能量,当上覆水盐度升高时,硫酸盐质量浓度也相应增加,在微生物共代谢过程中转化成的硫化物随反应时间延长逐渐增多,进而诱导了Desulfobacter种群丰度的大幅增长。
图 6(b)显示了随上覆水盐度的增加,底泥微生物属水平上群落结构的变化,不同上覆水盐度波动条件下底泥样品中微生物种群丰度和组成相差较大。在低盐度环境下(0~10‰),海细菌属(Marinobacterium)和海杆菌属(Marinobacter)为优势属(相对丰度高于2%),Marinobacterium和Marinobacter相对丰度分别为2.94%和2.88%。Marinobacter属于α-变形菌(α-Proteobacteria)的优势菌属,参与芳香烃的共代谢降解[43]。当上覆水盐度升高(超过10‰),底泥中广泛存在的Arcobacteraceae、Denitrovibrio、Oceanicaulis和Thalassospira的种群丰度显著降低,可见高盐环境对河道底泥土著菌群的胁迫影响。随上覆水盐度的升高,livecontrolB21、Sulfurovum、SBR1031和VadinHA17的种群丰度显著升高,说明此4类菌属与Arcobacteraceae等受高盐胁迫的菌属具有不同的环境适应机制,高盐环境诱导了其种群丰度的增长。
3 结论1) 低盐环境更利于微生物共代谢降解底泥PAHs。上覆水盐度过高对乙酸钠联合邻苯二甲酸的共代谢降解体系存在抑制作用,底泥PAHs降解率受限。同样,对底泥TOC的降解也表现出类似的影响。
2) 高盐环境产生的高渗透压会影响微生物活性,抑制共代谢反应的进行。随上覆水盐度的升高,底泥共代谢反应过程中pH不再升高,ORP下降变缓,SO42-的还原速率下降。
3) 高盐环境对河道底泥土著微生物菌群具有胁迫效应。低盐环境下Marinobacterium和Marinobacter为共代谢降解PAHs的优势菌属,而在高盐胁迫下这两类优势菌群的活性受到抑制,耐盐菌SBR1031和Sulfurovum逐渐成为新的优势菌属。
4) 在实际工程应用中,上覆水为低盐环境(0~20‰)下,更适合采用微生物共代谢技术降解污染河道底泥PAHs。
| [1] |
刘烨, 王玉洁, 汪福顺, 等. 多环芳烃在新安江河流-水库体系表层沉积物中的分布、来源及生态风险评估[J]. 上海大学学报(自然科学版), 2020, 26(1): 113. LIU Ye, WANG Yujie, WANG Fushun, et al. Distribution, source and ecological risk assessment of polycyclic aromatic hydrocarbons in surface sediments of Xin′an Jiang river-reservoir system[J]. Journal of Shanghai University (Natural Science Edition), 2020, 26(1): 113. |
| [2] |
林莉, 董磊, 李青云, 等. 三峡库区水体和底泥中多环芳烃和邻苯二甲酸酯类分布和来源[J]. 湖泊科学, 2018, 3(3): 660. LIN Li, DONG Lei, LI Qingyun, et al. Distribution and source of polycyclic aromatic hydrocarbons and phthalates in water and sediment of the Three Gorges Reservoir[J]. Lake Science, 2018, 3(3): 660. DOI:10.18307/2018.0308 |
| [3] |
张敬锁, 周洁, 刘晓霞, 等. 京郊灌渠水体和底泥中多环芳烃污染特征[J]. 环境污染与防治, 2017, 39(3): 236. ZHANG Jingsuo, ZHOU Jie, LIU Xiaoxia, et al. Pollution characteristics of polycyclic aromatic hydrocarbons in water and sediment of irrigation canals in Beijing suburbs[J]. Environmental Pollution and Prevention, 2017, 39(3): 236. DOI:10.15985/j.cnki.1001-3865.2017.03.003 |
| [4] |
DAVID K, JONATHAN D, BRIAN Y, et al. Turbidity hysteresis in an estuary and tidal river following an extreme discharge event[J]. Ecology Environment & Conservation, 2020, 47(15): 587. DOI:10.1029/2020GL088005 |
| [5] |
MA Xiaodong, LI Xia, LIU Junxiang, et al. Soil microbial community succession and interactions during combined plant/white-rot fungus remediation of polycyclic aromatic hydrocarbons[J]. Science of the Total Environment, 2020, 752: 1422. DOI:10.1016/j.scitotenv.2020.142224 |
| [6] |
CHAUDHARY D K, KIM J. New insights into bioremediation strategies for oil-contaminated soil in cold environments[J]. International Biodeterioration & Biodegradation, 2019, 142: 58. DOI:10.1016/j.ibiod.2019.05.001 |
| [7] |
孙井梅, 刘晓朵, 汤茵琪, 等. 微生物-生物促生剂协同修复河道底泥-促生剂投量对修复效果的影响[J]. 中国环境科学, 2019, 39(1): 351. SUN Jingmei, LIU Xiaoduo, TANG Yinqi, et al. The effect of the amount of micro-organism-biological promoters on the remediation of river sediment[J]. China Environmental Science, 2019, 39(1): 351. |
| [8] |
郑政伟, 李开明, 朱芳, 等. 底泥中多环芳烃的微生物降解与原位修复技术[J]. 环境科学与技术, 2010, 33(6): 49. ZHENG Zhengwei, LI Kaiming, ZHU Fang, et al. Microbial degradation and in-situ remediation of polycyclic aromatic hydrocarbons in sediment[J]. Environmental Science and Technology, 2010, 33(6): 49. DOI:10.3969/j.issn.1003-6504.2010.06.012 |
| [9] |
HOANG V, NGO H, GUO Wenshan, et al. Micropollutants cometabolism of microalgae for wastewater remediation: effect of carbon sources to cometabolism and degradation products[J]. Water Research, 2020, 183: 1159. DOI:10.1016/j.watres.2020.115974 |
| [10] |
LI Dunjie, SUN Liuying, FANG Hongli, et al. Effect of temperature on the anaerobic digestion of cardboard with waste yeast added: dose-response kinetic assays, temperature coefficient and microbial co-metabolism[J]. Journal of Cleaner Production, 2020, 275: 1229. DOI:10.1016/j.jclepro.2020.122949 |
| [11] |
ZHANG Shuangfei, HUANG Zhong, WU Hui. Metagenomic analysis exhibited the co-metabolism of polycyclic aromatic hydrocarbons by bacterial community from estuarine sediment[J]. Environment International, 2019, 129: 308. DOI:10.1016/j.envint.2019.05.028 |
| [12] |
BARZEGAR G, JORFI S, SOLTANI C, et al. Enhanced sono-Fenton-like oxidation of PAH-contaminated soil using nano-sized magnetite as catalyst: optimization with response surface methodology[J]. Soil and Sediment Contamination: An International Journal, 2017, 26(5): 538. DOI:10.1080/15320383.2017.1363157 |
| [13] |
衣俊. 潮滩沉积物微生物群落表征及其对污染物的响应研究[D]. 上海: 华东师范大学, 2019: 18 YI Jun. Study on microbial community characterization and its response to pollutants in tidal flat sediments[D]. Shanghai: East China Normal University, 2019: 18 |
| [14] |
SUN Wei, GAO Han, XIE Chu, et al. Effect of tidal flooding on ecosystem CO2 and CH4 fluxes in a salt marsh in the Yellow River delta[J]. Estuarine Coastal and Shelf Science, 2019, 232: 106512. DOI:10.1016/j.ecss.2019.106512 |
| [15] |
FANYI Z, JIAN S, BINLIANG L, et al. Seasonal hydrodynamic interactions between tidal waves and river flows in the Yangtze estuary[J]. Journal of Marine Systems, 2018, 186: 17. DOI:10.1016/j.jmarsys.2018.05.005 |
| [16] |
王郁, 李咏梅, 林逢凯, 等. 黄浦江底泥对多环芳烃吸附机理的研究[J]. 环境化学, 1997, 33(1): 15. WANG Yu, LI Yongmei, LIN Fengkai, et al. Study on the adsorption mechanism of polycyclic aromatic hydrocarbons by Huangpu River sediment[J]. Environmental Chemistry, 1997, 33(1): 15. DOI:10.1007/BF02951625 |
| [17] |
ZHONG Yin, ZOU Shichun, LIN Li, et al. Effects of pyrene and fluoranthene on the degradation characteristics of phenanthrene in the cometabolism process by Sphingomonas sp. strain PheB4 isolated from mangrove sediments[J]. Marine Pollution Bulletin, 2010, 60(11): 2043. DOI:10.1016/j.marpolbul.2010.07.017 |
| [18] |
TAM N F, WONG Y S. Effectiveness of bacterial inoculum and mangrove plants on remediation of sediment contaminated with polycyclic aromatic hydrocarbons[J]. Marine Pollution Bulletin, 2008, 57(6): 716. DOI:10.1016/j.marpolbul.2008.02.029 |
| [19] |
吴华财, 李拓. 城区感潮河道底泥污染特征调查研究[J]. 广东水利水电, 2018(10): 23. WU Huacai, LI Tuo. Investigation and study on sediment pollution characteristics of tidal river in urban area[J]. Guangdong Water Resources and Hydropower, 2018(10): 23. |
| [20] |
刘大海, 李彦平, 李铁刚, 等. 海洋沉积物修复技术进展及发展方向初探[J]. 环境科学与技术, 2017, 40(增刊1): 150. LIU Dahai, LI Yanping, LI Tiegang, et al. Progress and development direction of marine sediment remediation technology[J]. Environmental Science and Technology, 2017, 40(Sup.1): 150. |
| [21] |
王鸣, 吴海珍, 刘雷, 等. 厌氧条件下不同共基质对焦化污泥降解多环芳烃的影响[J]. 生态环境学报, 2016, 25(3): 510. WANG Ming, WU Haizhen, LIU Lei, et al. Effect of different co-substrates on degradation of polycyclic aromatic hydrocarbons by coking sludge under anaerobic conditions[J]. Journal of Ecological Environment, 2016, 25(3): 510. DOI:10.16258/j.cnki.1674-5906.2016.03.021 |
| [22] |
WANG Feng, DONG Wenyi, WANG Hongjie, et al. Enhanced bioremediation of sediment contaminated with polycyclic aromatic hydrocarbons by combined stimulation with sodium acetate/phthalic acid[J]. Chemosphere, 2022, 291: 132770. DOI:10.1016/j.chemosphere.2021.132770 |
| [23] |
GUO Guang, HE Fen, TIAN Fang, et al. Effect of salt contents on enzymatic activities and halophilic microbial community structure during phenanthrene degradation[J]. International Biodeterioration & Biodegradation, 2016, 110: 8. DOI:10.1016/j.ibiod.2016.02.007 |
| [24] |
彭子淇, 罗宇同, 陆阳阳, 等. 我国主要河口沉积物中多环芳烃细菌降解及生物修复强化方式的研究进展[J]. 微生物学报, 2022, 62(6): 2311. PENG Ziqi, LUO Yutong, LU Yangyang, et al. Research progress on bacterial degradation and enhanced bioremediation of polycyclic aromatic hydrocarbons in sediments of major estuaries in China[J]. Journal of Microbiology, 2022, 62(6): 2311. |
| [25] |
THOMAS S, SOLTERO R. Recent sedimentary history of a eutrophic reservoir-Long Lake, Washington[J]. Journal of the Fisheries Research Board of Canada, 1977, 34(5): 669. DOI:10.1139/f77-103 |
| [26] |
VIJENDRA S, ACHLESH D. Effects of sophorolipids augmentation on the plant growth and phytoremediation of heavy metal contaminated soil[J]. Journal of Cleaner Production, 2021, 280(1): 1. DOI:10.1016/j.jclepro.2020.124406 |
| [27] |
朱凡, 洪湘琦, 闫文德, 等. PAHs污染土壤植物修复对酶活性的影响[J]. 生态学报, 2014, 34(3): 581. ZHU Fan, HONG Xiangqi, YAN Wende, et al. Effect of phytoremediation of PAHs contaminated soil on enzyme activity[J]. Journal of Ecology, 2014, 34(3): 581. DOI:10.5846/stxb201301040020 |
| [28] |
常春. 盐胁迫对苜蓿营养品质及附着微生物群落的影响[J]. 动物营养学报, 2023, 35(1): 11. CHANG Chun. Effects of salt stress on nutrient quality and attached microbial community of alfalfa[J]. Journal of Animal Nutrition, 2023, 35(1): 11. DOI:10.3969/j.issn.1006-267x.2023.01.043 |
| [29] |
安鸿雪. 盐度对序批式生物膜反应器性能及微生物活性影响[J]. 中国海洋大学学报(自然科学版), 2019, 49(7): 8. AN Hongxue. Effect of salinity on performance and microbial activity of sequencing batch biofilm reactor[J]. Journal of Ocean University of China (Natural Science Edition), 2019, 49(7): 8. DOI:10.19965/j.cnki.iwt,2023-01-14 |
| [30] |
李季东, 肖利娟, 韩博平. 一座南亚热带中富营养水库夏季浮游植物群落的稳态平衡分析[J]. 应用与环境生物学报, 2011, 17(6): 833. LI Jidong, XIAO Lijuan, HAN Boping. Steady state balance analysis of phytoplankton community in a subtropical mesotrophic reservoir in summer[J]. Journal of Applied and Environmental Biology, 2011, 17(6): 833. DOI:10.3724/SP.J.1145.2011.00833 |
| [31] |
MICHAEL H K, CHIHHAO F, SHUYUAN P, et al. Kinetics of competitive cometabolism under aerobic conditions[J]. Water-Energy Nexus, 2020, 3: 62. DOI:10.1016/j.wen.2020.04.001 |
| [32] |
WU Siyu, HE Guangxuan, CAI Xiaojing, et al. Effect of tidal flooding on ecosystem CO2 and CH4 fluxes in a salt marsh in the Yellow River delta[J]. Estuarine, Coastal and Shelf Science, 2019, 33: 106512. DOI:10.1016/j.ecss.2019.106512 |
| [33] |
HORVATH R S. Enhancement of co-metabolism of chlorobenzoates by the co-substrate enrichment technique[J]. Applied Microbiology, 1973, 25(6): 961. DOI:10.1128/AEM.25.6.961-963.1973 |
| [34] |
吴自军, 任德章, 周怀阳. 海洋沉积物甲烷厌氧氧化作用(AOM)及其对无机硫循环的影响[J]. 地球科学进展, 2013, 28(7): 765. WU Zijun, REN Dezhang, ZHOU Huaiyang. Anaerobic oxidation of methane (AOM) in marine sediments and its effect on inorganic sulfur cycle[J]. Progress in Earth Science, 2013, 28(7): 765. DOI:10.11867/j.issn.1001-8166.2013.07.0765 |
| [35] |
IDA H S, MARIT S M, NILS-KÅRE B, et al. Purification and characterization of a monomeric isocitrate dehydrogenase from the sulfate-reducing bacterium desulfobacter vibrioformis and demonstration of the presence of a monomeric enzyme in other bacteria[J]. FEMS Microbiology Letters, 1998, 160(1): 75. DOI:10.1016/S0378-1097(98)00083-4 |
| [36] |
段文松, 黄观超, 郝敏, 等. 环境因素变化下城市黑臭水体中硫元素的释放特性[J]. 科学技术与工程, 2020, 20(31): 13072. DUAN Wensong, HUANG Guanchao, HAO Min, et al. The release characteristics of sulfur in urban black and odorous water under the change of environmental factors[J]. Science, Technology and Engineering, 2020, 20(31): 13072. DOI:10.12030/j.cjee.202008188 |
| [37] |
CHANG B V, SHIUNG L C, YUAN S Y. Anaerobic biodegradation of polycyclic aromatic hydrocarbon in soil[J]. Chemosphere, 2002, 48(7): 717. DOI:10.1016/S0045-6535(02)00151-0 |
| [38] |
李志杰, 郭长城, 石杰, 等. 高通量测序解析多环芳烃污染盐碱土壤翅碱蓬根际微生物群落多样性[J]. 微生物学通报, 2017, 44(7): 1602. LI Zhijie, GUO Changcheng, SHI Jie, et al. High-throughput sequencing and analysis of microbial community diversity in the rhizosphere of pteridophyte in saline-alkali soil contaminated by polycyclic aromatic hydrocarbons[J]. Microbiology Bulletin, 2017, 44(7): 1602. DOI:10.13344/j.microbiol.china.170164 |
| [39] |
李小飞, 侯立军, 刘敏. 长江口潮滩沉积物古菌群落结构与多样性[J]. 中国环境科学, 2019, 39(4): 1744. LI Xiaofei, HOU Lijun, LIU Min. The structure and diversity of archaea community in tidal flat sediments of the Yangtze River estuary[J]. China Environmental Science, 2019, 39(4): 1744. |
| [40] |
KERR R P, CAPONE D G. The effect of salinity on the microbial mineralization of two polycyclic aromatic hydrocarbons in estuarine sediments[J]. Marine Environmental Research, 1988, 26: 181. DOI:10.1016/0141-1136(88)90026-8 |
| [41] |
杨青青, 李朋辉, 黄清辉. 河口盐度梯度下溶解态核酸的微生物可利用性[J]. 环境科学, 2013, 34(7): 2597. YANG Qingqing, LI Penghui, HUANG Qinghui. Microbial availability of dissolved nucleic acid under salinity gradient in estuaries[J]. Environmental Science, 2013, 34(7): 2597. |
| [42] |
MASAYA F, TAICHI S, KENTA T, et al. Author correction: iron acquisition system of Sphingobium sp. strain syk-6, a degrader of lignin-derived aromatic compounds[J]. Scientific Reports, 2020, 10(1): 1038. DOI:10.1038/s41598-020-73843-1 |
| [43] |
SARKAR J, KAZY S K, GUPTA A, et al. Biostimulation of indigenous microbial community for bioremediation of petroleum refinery sludge[J]. Frontiers in Microbiology, 2016, 7: 1407. DOI:10.3389/fmicb.2016.01407 |
 2024, Vol. 56
2024, Vol. 56


