2. 哈尔滨工业大学 市政环境工程学院,哈尔滨 150090
2. School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China
污水处理过程中产生的大量污泥容易导致二次环境污染, 进一步的污泥处理和处置增加了污水处理的成本, 限制了污水处理工艺的大规模应用.目前, 作为一项有效的生态技术, 利用微型动物捕食污泥越来越受到关注[1-2].研究表明, 与传统MBR相比, MBR+蠕虫反应器组合工艺具有同步废水处理和污泥减量的特点[3].然而,关于蠕虫捕食对MBR膜污染影响的研究较少.随着MBR膜污染程度的加深, 影响膜污染的微生物代谢产物质量浓度增高, 如溶解性代谢产物(SMP)以及胞外聚合物(EPS)[4].微生物群落结构对膜污染也具有一定影响, 膜污染发展变化过程中, 微生物群落不断演替并最终形成分泌大量黏性物质的优势种群, 此时膜污染程度最深[5-8].为研究蠕虫捕食对膜污染的影响, 通过实验比较了MBR+蠕虫反应器在接种和不接种蠕虫的不同工艺条件下, 微生物代谢产物及微生物群落结构特征, 探索了微生物代谢产物、微生物种群结构与膜污染之间的关系.进一步探讨了微生物引起的膜污染机理.
1 实验 1.1 实验材料MBR接种污泥取自哈尔滨太平污水处理厂二沉池, 污泥经反应器驯化后, MLSS (混合液悬浮固体)质量浓度控制在9 000~10 000 mg·L-1.蠕虫反应器接种污泥为MBR产生的剩余活性污泥, 运行过程中MLSS质量浓度控制在3 000~4 000 mg·L-1.进水为人工模拟生活污水, COD为(337.9±17.2) mg·L-1, NH3-N为(28.2±1.4) mg·L-1, TN (总氮)为(30.5±1.2) mg·L-1, pH为7.5±0.2.
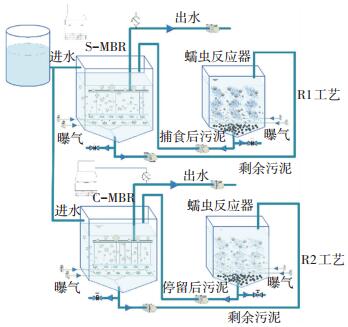
1.2 反应器装置MBR+蠕虫反应器(R1)和作为对照系统的MBR+空白蠕虫反应器(R2)如图 1所示, R1工艺的蠕虫反应器接种蠕虫, R2工艺的空白蠕虫反应器不接种蠕虫.反应器壁的材质为透明有机玻璃, 便于观察反应状态. S-MBR和C-MBR有效容积均为40 L, 都安装一个中空纤维滤膜组件, 有效过滤面积为1 m2, 膜孔径为0.2 μm.蠕虫反应器及空白蠕虫反应器有效容积均为39 L, 两个反应器内都均匀分布多层数个填充了聚乙烯多孔性填料的穿孔板筐, 作为蠕虫的载体.实验所用蠕虫主要为颤蚓类, 经驯化后接种到蠕虫反应器中.蠕虫反应器中穿孔板的面积为0.36 m2, 蠕虫总质量为0.096 kg, 反应器运行过程中蠕虫密度控制在湿重0.27 kg/m2左右.
|
图 1 MBR+蠕虫反应器(R1)和MBR+空白蠕虫反应器(R2) Figure 1 MBR+worm reactor (R1) and MBR+worm reactor without worms (R2) |
同时平行运行R1和R2工艺, 运行条件如表 1所示.蠕虫反应器和空白蠕虫反应器运行过程中均采用连续微曝气和间歇强曝气结合的曝气方式, 连续微曝气风速为0.01~0.05 m3/h, 间歇强曝气风速为0.2~0.3 m3/h, 持续5 min, 频率为12次·d-1, 反应器内的溶解氧(DO)质量浓度保持在1.0~1.5 mg/L [3].每隔24 h, S-MBR和C-MBR中4.5 L污泥分别排入蠕虫反应器和空白蠕虫反应器, 与上一个24 h运行周期结束时剩下的污泥混合液混合; 24 h运行结束后, 蠕虫反应器和空白蠕虫反应器中的污泥沉淀30 min, 4.5 L的污泥混合液(沉淀污泥和少量上清液)排出反应器, 回流到S-MBR和C-MBR.
| 表 1 工艺运行条件 Table 1 Parameters of reactors |
采用国家标准方法, 每隔3 d测定S-MBR和C-MBR进水和出水的COD、NH3-N、NO3-N、NO2-N. DO、pH和温度,分别利用JCB-607便携式溶解氧仪、PHSJ-3F实验室pH计和温度计测定. MBR运行过程中,利用膜组件上的真空压力表测定pTM, 表征膜污染程度。
1.4.2 样品处理泥饼层分离方法:选取膜污染周期结束时S-MBR和C-MBR反应器上的膜丝1~2根, 截取中间位置的等长段, 用等量的磷酸盐缓冲溶液将膜丝上的泥饼层冲洗下来, 分别置于离心管中, 用于EPS和DNA提取.
膜丝表面凝胶层分离方法:将冲洗后的膜丝放入离心管中, 加入PBS缓冲溶液进行超声破碎.微生物样品经过超声震动后从膜丝表面脱离到离心管的缓冲溶液中, 按照DNA试剂盒提取方法进行样品中微生物DNA的提取.
1.4.3 SMP、EPS提取方法样品置于离心管中, 5 000 r/min离心5 min, 取上清液经0.45 μm滤膜过滤, 所得滤液即为SMP; 用蒸馏水将离心管中剩余污泥重新定容至原体积, 混合均匀后水浴(80 ℃, 30 min), 离心(5 000 r/min, 5 min), 上清液经0.45 μm滤膜过滤后, 滤液用于EPS分析[9].
1.4.4 微生物群落结构分析利用PCR-DGGE分子生物学方法[10]分析S-MBR和C-MBR中微生物群落结构特征. PCR引物为GC夹的338F和518R[11].
2 结果与讨论 2.1 工艺运行效果比较S-MBR和C-MBR连续运行90 d, 出水COD平均分别为(26.5±5.4)和(25.9±7.3) mg·L-1, COD去除效率分别为(92.4±1.4)%和(92.6±2.0)%; NH3-N平均质量浓度分别为(2.1±0.5)和(2.2±0.8) mg·L-1, NH3-N去除效率分别为(92.6±2.1)%和(92.1±2.8)%.实验结果表明尽管蠕虫捕食释放大量的营养物质(COD和NH3-N)[3], S-MBR仍保持较高的COD和NH3-N去除效率(见表 2).
| 表 2 S-MBR和C-MBR废水处理效果 Table 2 Performance of the S-MBR and the C-MBR treating the synthetic wastewater |
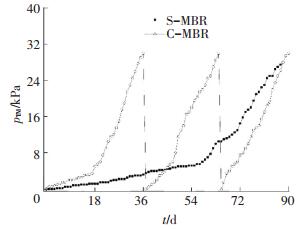
S-MBR和C-MBR连续运行90 d, 分别监测S-MBR和C-MBR的pTM变化, 如图 2所示.当pTM达30 kPa时, 一个膜污染周期结束.C-MBR的膜污染周期较短为28~37 d, 平均pTM增长速率为1.0 kPa/d. S-MBR的膜污染周期较长为90 d, 平均pTM增长速率为0.3 kPa/d, 较C-MBR降低了70%.由图 2可看出, 蠕虫捕食可有效地减缓S-MBR的膜污染速率.
|
图 2 S-MBR和C-MBR反应器pTM随运行时间变化 Figure 2 Changes of pTM in the S-MBR and C-MBR |
工艺运行至90 d时, S-MBR和C-MBR反应器pTM均达30 kPa, 分别对各MBR反应器污泥混合液、生物膜表面泥饼层中微生物代谢产物的成分及其质量浓度进行分析, 结果如表 3所示.可以看出, S-MBR污泥混合液中SMP的糖类和蛋白质类物质质量浓度分别为8.1和7.9 mg·L-1, 较C-MBR低14.7%和18.6%; EPS的糖类和蛋白类物质较C-MBR低2.5%和23.4%. S-MBR中膜表面泥饼层SMP的糖类和蛋白质类物质质量浓度分别为13.5和11.7 mg·L-1, 较C-MBR低24.2%和22.5%; EPS的糖类和蛋白质类物质较C-MBR低3.1%和13.4%.实验结果表明, 与污泥暂时停留在空白蠕虫反应器中相比, 蠕虫捕食污泥可有效地减少S-MBR中污泥混合液及膜表面泥饼层上SMP和EPS的糖类和蛋白质类物质质量浓度.
| 表 3 S-MBR和C-MBR反应器微生物代谢产物 Table 3 Microbial metabolites of the S-MBR and the C-MBR |
有研究表明, SMP和EPS在生物污染物和膜表面泥饼层形成过程中起到重要作用[12-13], 其中蛋白质和糖类物质可导致膜污染[14].在MBRs膜污染过程中, 膜丝上的微生物代谢产物及微生物菌群的黏附使膜孔阻塞, 膜通量降低.由此推断, S-MBR中污泥混合液及膜表面泥饼层中较低质量浓度的糖类和蛋白质类物质与S-MBR的膜污染减轻有关; 可以通过生态技术手段改变微生物群落结构, 降低产生胞外聚合物的微生物数量, 从而达到延缓膜污染的目的.
2.3 微生物群落与膜污染关系反应器的核心组成主要是活性污泥中的微生物种群[15], 微生物群落结构的特征决定了反应器的功能和运行效果。反应器运行结束时, 即第90天, S-MBR和C-MBR的膜孔被完全堵塞,膜污染周期终止.此时, 分别在S-MBR和C-MBR反应器内对污泥混合液、膜上泥饼层以及膜丝表面凝胶层取样, 分析其微生物群落结构, 结果见图 3.

|
图 3 基于16S rDNA PCR产物的DGGE图谱 Figure 3 DGGE profile based on the 16S rDNA PCR products |
根据图 3, 对DGGE图谱中主要条带进行测序分析, 结果如表 4所示.由图 3和表 4可以看出, 无论是S-MBR还是C-MBR, 不同的生态环境微生物种群结构也不相同.每种微生物种群都有其自身所适应的生态位, 并且随着周围环境的变化而进行演替.通过对比两个MBRs相同生态位上的微生物种群发现, S-MBR的微生物群落结构与C-MBR中不同, 这可能与蠕虫捕食有关.
| 表 4 16S rDNA序列比对结果 Table 4 Results of the 16S rDNA sequences |
另外, S-MBR和C-MBR中污泥混合液的微生物种群结构与其泥饼层的相似, 而与膜丝上的微生物种群基本不同. MBRs反应器运行过程中, 由于曝气强度较高造成水力和气流在膜的泥饼层上不断搅动, 导致膜上泥饼层与污泥混合液不断融合, 形成相似的微生物群落结构; 而膜丝表面上的微生物由于受污泥混合液的冲击较少, 其种群结构与污泥混合液及泥饼层的差别较大.
膜污染周期结束, 膜压30 kPa时, S-MBR膜丝表面的主要微生物为Proteobacteria (变形菌门)的Alphaproteobacterium、Betaproteobacterium、Deltaproteobacterium(变形菌属)、Geobacter(地杆菌属), Chloroflexi (绿弯菌门)的Caldilinea(暖绳菌属)和Bacteria; C-MBR膜丝表面的主要微生物为Proteobacteria (变形菌门)的Azorhizobium(生丝微菌属)、Rhodobacter(红细菌属)、Gammaproteobacterium(变形菌属), Bacteroidetes (拟杆菌门)的Flavobacteria(黄杆菌属), Firmicutes (厚壁菌门)的Thermoanaerobacteriales(热厌氧杆菌目)、Uncultured Firmicutes bacterium和Bacteria.其中, Proteobacteria (变形菌门)和Bacteroidetes (拟杆菌门)易在膜组件形成优势菌群, 同时使膜组件容易发生污染[8].因此推断, S-MBR和C-MBR膜丝表面上检测到的Proteobacteria (变形菌门)和Bacteroidetes (拟杆菌门)对反应器的膜污染具有重要作用.
另外, Proteobacteria (变形菌门)的Paracoccus(副球菌属)为具有反硝化作用的菌属, 表面可产生黏液层, 利于细胞间的黏连, 对膜污染的发展贡献较大[4].蠕虫反应器中存在同步硝化反硝化过程[16], 由于捕食后污泥的回流, S-MBR的污泥混合液、膜上泥饼层和膜丝表面上都发现了Paracoccus(副球菌属), 负面影响了反应器的膜污染进程.与C-MBR相比, Chloroflexi (绿弯菌门)的Caldilinea(暖绳菌属)存在S-MBR的污泥混合液、膜上泥饼层和膜丝表面上不同的生态环境中. Chloroflexi (绿弯菌门)可降解SMP中的碳水化合物及细胞物质, 减少其膜污染倾向, 对MBR处理城市废水具有重要的生态意义[17].因此推断, S-MBR中存在Chloroflexi (绿弯菌门)的Caldilinea(暖绳菌属)可能与反应器膜污染减轻有关.
3 结论1) MBR+蠕虫反应器工艺能显著降低膜污染速率, 延长膜污染周期. S-MBR膜污染周期为90 d, 膜污染速率为0.3 kPa/d; C-MBR为28~37 d, 1.0 kPa/d.
2) 蠕虫捕食污泥可有效地减少MBR污泥混合液及膜表面泥饼层中SMP和EPS的糖类和蛋白质类物质质量浓度.
3) S-MBR膜丝表面的主要微生物为Proteobacteria (变形菌门)的Alphaproteobacterium、Betaproteobacterium、Deltaproteobacterium(变形菌属)、Geobacter(地杆菌属); 而C-MBR膜丝表面主要是Proteobacteria (变形菌门)的Azorhizobium(生丝微菌属)、Rhodobacter(红细菌属)、Gammaproteobacterium(变形菌属), Bacteroidetes (拟杆菌门)的Flavobacteria(黄杆菌属).二者的微生物群落结构明显不同.
4) S-MBR污泥混合液、泥饼层和膜丝上均检测到Chloroflexi (绿弯菌门)的Caldilinea(暖绳菌属), 可能与反应器的膜污染减轻有关.
| [1] | HENDRICKX T L G, ELISSEN H J H, TEMMINK H, et al. Operation of an aquatic worm reactor suitable for sludge reduction at large scale[J]. Water Research, 2011, 45 (16) : 4923-4929. DOI: 10.1016/j.watres.2011.06.031 |
| [2] | TAMIS J, SCHOUWENBURG VAN G, KLEEREBEZEM R, et al. A full scale worm reactor for efficient sludge reduction by predation in a wastewater treatment plant[J]. Water Research, 2011, 45 (18) : 5916-5924. DOI: 10.1016/j.watres.2011.08.046 |
| [3] | TIAN Y, LU Y B, LI Z P. Performance analysis of a combined system of membrane bioreactor and worm reactor: Wastewater treatment, sludge reduction and membrane fouling[J]. Bioresource Technology, 2012, 121 : 176-182. DOI: 10.1016/j.biortech.2012.06.071 |
| [4] |
高大文, 辛晓东. MBR膜污染过程中微生物群落结构与代谢产物分析[J].
哈尔滨工业大学学报, 2014, 46 (2) : 26-32.
GAO Dawen, XIN Xiaodong. Analysis of microbial community structure and metabolites during the MBR membrane fouling process[J]. Journal of Harbin Institute of Technology, 2014, 46 (2) : 26-32. |
| [5] |
张斌, 孙宝盛, 刘慧娜, 等. 处理不同废水MBR系统中微生物群落结构的比较[J].
环境科学, 2008, 29 (10) : 2944-2949.
ZHANG Bin, SUN Baosheng, LIU Huina, et al. Comparison of microbial community structure in MBRs treating different wastewater[J]. Environmental Science, 2008, 29 (10) : 2944-2949. |
| [6] | LIM S Y, KIM S, YEON K M, et al. Correlation between microbial community structure and biofouling in a laboratory scale membrane bioreactor with synthetic wastewater[J]. Desalination, 2012, 287 : 209-215. DOI: 10.1016/j.desal.2011.09.030 |
| [7] | GAO W J, LIN H J, LEUNG K T, et al. Structure of cake layer in a submerged anaerobic membrane bioreactor[J]. Journal of Membrane Science, 2011, 374 (1) : 110-120. DOI: 10.1016/j.memsci.2011.03.019 |
| [8] | HUANG L N, WEVER H D, DIELS L. Diverse and distinct bacterial communities induced biofilm fouling in membrane bioreactors operated under different conditions[J]. Environmental Science & Technology, 2008, 42 (22) : 8360-8366. DOI: 10.1021/es801283q |
| [9] |
卢耀斌. MBR+蠕虫床污泥减量效能及膜污染控制机制[D].哈尔滨:哈尔滨工业大学, 2014.
LU Yaobin. Research on a combined system of membrane bioreactor and worm reactor for sludge reduction and membrane fouling mitigation[D].Harbin: Harbin Institute of Technology, 2014. |
| [10] |
高琼. 聚合酶链式反应(PCR)技术在环境监测中的应用[J].
安徽农业科学, 2014, 42 (36) : 12825-12828.
GAO Qiong. Application of polymerase chain reaction (PCR) technology in environmental monitoring[J]. Journal of Anhui Agri Sci, 2014, 42 (36) : 12825-12828. |
| [11] | LAPARA T M, NAKATSU C H, PANTEA L M, et al. Stability of the bacterial communities supported by a seven-stage biological process treating pharmaceutical wastewater as revealed by PCR-DGGE[J]. Water Research, 2002, 36 (3) : 638-646. DOI: 10.1016/S0043-1354(01)00277-9 |
| [12] | FLEMMING H C, SCHAULE G, GRIEBE T, et al. Biofouling-the achilles heel of membrane processes[J]. Desalination, 1997, 113 (2) : 215-225. DOI: 10.1016/S0011-9164(97)00132-X |
| [13] | RAMESH A, LEE D J, LAI J Y. Membrane biofouling by extracellular polymeric substances or soluble microbial products from membrane bioreactor sludge[J]. Applied Microbiology and Biotechnology, 2007, 74 (3) : 699-707. DOI: 10.1007/s00253-006-0706-x |
| [14] | GVELL C, DAVIS R H. Membrane fouling during microfiltration of protein mixtures[J]. Journal of Membrane Science, 1996, 119 (2) : 269-284. DOI: 10.1016/0376-7388(96)80001-J |
| [15] | WAN C Y, WEVER H D, DIELS L, et al. Biodiversity and population dynamics of microorganisms in a full-scale membrane bioreactor for municipal wastewater treatment[J]. Water Research, 2011, 45 (3) : 1129-1138. DOI: 10.1016/j.watres.2010.11.008 |
| [16] | TIAN Y, LU Y B. Simultaneous nitrification and denitrification process in a new tubificidae-reactor for minimizing nutrient release during sludge reduction[J]. Water Research, 2010, 44 (20) : 6031-6040. DOI: 10.1016/j.watres.2010.07.069 |
| [17] | MIURA Y, WATANABE Y, OKABE S. Significance of chloroflexi in performance of submerged membrane bioreactors (MBR) treating municipal wastewater[J]. Environmental Science & Technology, 2007, 41 (22) : 7787-7794. DOI: 10.1021/es071263x |
 2017, Vol. 49
2017, Vol. 49


